
Protactínio
Sobre este escolas selecção Wikipedia
SOS acredita que a educação dá uma chance melhor na vida de crianças no mundo em desenvolvimento também. Uma boa maneira de ajudar outras crianças é por patrocinar uma criança
| Protactínio | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
91 Pa | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||||||||||||||||||||||
brilhante, brilho metálico prateado  | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | protactinium, Pa, 91 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / ˌ p r oʊ t æ k t ɪ n Eu ə m / PROH -tak- TIN -ee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria elemento | actinide | ||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | n / D, 7, f | ||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | 231,03588 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Rn ] 5f 2 6d 1 7s 2 2, 8, 18, 32, 20, 9, 2 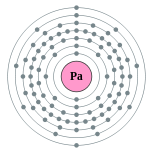 | ||||||||||||||||||||||||||||||||||||||||||||||||
| História | |||||||||||||||||||||||||||||||||||||||||||||||||
| Predição | Dmitri Mendeleev (1869) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Descoberta | William Crookes (1900) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Primeiro isolamento | William Crookes (1900) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Nomeado por | Otto Hahn e Lise Meitner (1917-8) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 15,37 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 1841 K , 1568 ° C, 2854 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | ? 4300 K,? 4027 ° C,? 7280 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusão | 12,34 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporização | 481 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 2, 3, 4, 5 (Fracamente óxido de base) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 1,5 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização | 1º: 568 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atômico | 163 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 200 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | tetragonal  | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | paramagnético | ||||||||||||||||||||||||||||||||||||||||||||||||
| Resistividade elétrica | (0 ° C) 177 Nco · m | ||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 47 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-13-3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de protactinium | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Protactinium é um elemento químico com o símbolo Pa e número atômico 91. É um metal denso, cinza-prateado, que prontamente reage com o oxigênio , o vapor de água e inorgânicos ácidos . Faz vários compostos químicos , onde protactinium geralmente está presente no estado de oxidação +5, mas também pode assumir quatro e até mesmo dois ou três estados. As concentrações médias de protactinium na crosta da Terra é tipicamente da ordem de algumas partes por trilhão, mas pode chegar a até algumas partes por milhão, de alguma depósitos de minério de uraninita. Por causa de sua escassez, alta radioatividade e alta toxicidade, não há atualmente nenhum uso para o protactínio fora da investigação científica, e para este fim, protactinium é principalmente extraído de gasto combustível nuclear.
Protactinium foi identificado pela primeira vez em 1913 por Kasimir Fajans e Oswald Helmuth Göhring e nomeado brevium devido à curta meia-vida do específico isótopo estudados, ou seja, protactinium-234. Um isótopo mais estável (231 Pa) de protactinium foi descoberto em 1917/18 por Otto Hahn e Lise Meitner, e eles escolheram o nome proto-actinium, mas, em seguida, o IUPAC nomeou-o finalmente Protactínio em 1949 e confirmado Hahn e Meitner como descobridores. O novo nome significa "pai de actinium "e refletiu o fato de que actinium é um produto do decaimento radioativo do protactínio.
A mais longa duração e mais abundante (quase 100%) de ocorrência natural do isótopo de protactinium, protactinium-231, tem uma meia-vida de 32.760 anos e é um produto de decaimento do urânio-235. Pequenas quantidades muito menores do curta duração isômero nuclear protactinium-234m ocorrer na cadeia de decaimento do urânio-238. Resulta da decomposição de 233 Protactinium- tório -233 como parte da cadeia de eventos usados para produzir urânio-233 por irradiação de neutrões de tório-232. É um produto intermediário indesejado no tório baseada- reactores nucleares e é, por conseguinte, removido da zona activa do reactor durante o processo de criação. A análise das concentrações relativas dos vários urânio e tório e Protactínio isótopos em água e minerais é utilizada no datação radiométrica de sedimentos que são até 175 mil anos de idade e na modelagem de vários processos geológicos.
História
Em 1871, Dmitri Mendeleev previu a existência de um elemento entre tório e urânio . O grupo elemento actinide era desconhecido na época. Portanto, o urânio foi posicionado abaixo de tungstênio e tório abaixo de zircônio, deixando o espaço abaixo tântalo vazio, e até 1950 tabelas periódicas foram publicados com esta estrutura. Durante muito tempo os químicos procurou-EKA tântalo como um elemento com propriedades químicas semelhantes como tântalo, fazendo uma descoberta de Protactínio quase impossível.
Em 1900, William Crookes isolado protactinium como um material altamente radioactivos de urânio; no entanto, ele não poderia caracterizá-lo como um novo elemento químico e, assim, nomeou-o urânio-X. Crookes dissolvido nitrato de urânio em éter , a fase aquosa residual contém mais do 234
90 Th e 234
91 Pa. Seu método foi usado ainda na década de 1950 para isolar 234
90 Th e 234
91 Pa a partir de compostos de urânio. Protactinium foi identificado pela primeira vez em 1913, quando Kasimir Fajans e Oswald Helmuth Göhring encontrou o isótopo 234 Pa durante os seus estudos das cadeias de desintegração de urânio-238: 238
92 U → 234
90 Th → 234
91 Pa → 234
92 L. Eles nomearam o novo brevium elemento (da palavra latina, brevis, ou seja, breve ou curto) por causa de sua meia-vida curta, 6,7 horas para 234
91 Pa. Em 1917/18, dois grupos de cientistas, Otto Hahn e Lise Meitner da Alemanha e Frederick Soddy e John Cranston da Grã-Bretanha , descobriram de forma independente outro isótopo de protactinium, 231 Pa tendo muito mais tempo de semi-vida de cerca de 32.000 anos. Assim, o nome foi mudado para brevium protoactinium como o novo elemento foi parte da cadeia de decaimento do urânio-235 antes do actinium (do grego : πρῶτος = protos que significa em primeiro lugar, antes). Para facilidade de pronúncia, o nome foi encurtado para protactinium pelo IUPAC em 1949. A descoberta de protactinium concluída a última lacuna nas primeiras versões da tabela periódica, proposto por Mendeleev em 1869, e que trouxe à fama dos cientistas envolvidos.
Aristid von Grosse produziu 2 miligramas de Pa 2 O 5 em 1927, e em 1934 primeiro protactinium elementar isolado a partir de 0,1 mg de Pa 2 O 5. Ele usou dois procedimentos diferentes: no primeiro, o óxido de protactinium foi irradiados por 35 elétrons keV em vácuo. Num outro método, chamado o van Arkel processo-de Boer, o óxido foi convertido quimicamente a um haleto ( cloreto, ou brometo iodeto) e, em seguida, reduzida em vácuo com um filamento metálico aquecido electricamente:
- 2 Pai 5 → 2 + 5 Pa I 2
Em 1961, os britânicos Atomic Energy Authority (UKAEA) produziu 125 gramas de protactínio 99,9% puro, processando 60 toneladas de material de desperdício em um processo de 12 etapas, com um custo de cerca de 500.000 USD. Por muitos anos, esta foi apenas oferta significativa do mundo de protactinium, que foi fornecido a vários laboratórios para estudos científicos. Oak Ridge National Laboratory, em os EUA está atualmente fornecendo protactinium a um custo de cerca de 280 USD / grama.

Ocorrência
Protactinium é um dos elementos mais raros e mais caros que ocorrem naturalmente. Pode ser encontrada sob a forma de dois isótopos - 231 Pa e 234 Pa, com o isótopo 234 Pa ocorrendo em dois estados de energia diferentes. Quase todos protactinium natural é protactinium-231. É um emissor alfa e é formado pelo decaimento do urânio-235, enquanto que o beta irradiando protactinium-234 é produzido como resultado de urânio-238 decadência . Quase todos urânio-238 (99,8%) decai primeiro a 234m do Pa isômero.
Protactinium ocorre em uraninite (uraninita) em concentrações de cerca de 0,3-3 231 partes por milhão de partes Pa (ppm) de minério. Considerando que o teor habitual está mais perto de 0,3 ppm (por exemplo, em Jáchymov, República Checa ), alguns minérios a partir da República Democrática do Congo tem cerca de 3 ppm. Protactínio está homogeneamente disperso na maioria dos materiais naturais e em água, mas em concentrações muito baixas na ordem de uma parte por mil milhões, que corresponde à radioactividade de 0,1 picocuries (PCI) / g. Há cerca de 500 vezes mais Protactínio em partículas de solo arenoso do que em água, mesmo a água presente na mesma amostra de solo. Rácios muito mais elevados de 2000 e acima são medidos em solos argilosos e argilas, tais como bentonite.
Em reatores nucleares
Dois grandes isótopos protactinium, 231 Pa e 233 Pa, são produzidos a partir de tório em reatores nucleares; ambos são indesejáveis e são normalmente removidas, aumentando assim a complexidade do desenho do reactor e de operação. Em particular, 232 através de Th (n, 2) n reacções produz 231 Th que rapidamente (meia-vida 25,5 horas), decai para 231 Pa. A última isótopo, enquanto não um desperdício transuranic, tem uma meia-vida longa de 32.760 anos e é um dos principais contribuintes para o longo prazo radiotoxicidade do combustível nuclear irradiado.
Protactinium-233 é formada após a captura de nêutrons por 232 Th. É mais ou decai para o urânio-233 ou captura outro nêutron e converte para o não-físsil do urânio-234. 233 Pa tem uma meia-vida relativamente longa de 27 dias e de alta secção transversal de captura de neutrões (o chamado " nêutrons veneno "). Assim, em vez de rápida decomposição ao útil 233 U, uma fração significativa de 233 Pa converte em isótopos físseis e não consome nêutrons, degradando a eficiência do reactor. Para evitar esta situação, 233 Pa, é extraído da zona activa de tório reactores de sais fundidos, durante a sua operação, de modo que só se decompõe a 233 U. Isto é conseguido utilizando vários metros de altura colunas de fundido de bismuto com lítio dissolvido na mesma. Num cenário simplificado, lítio reduz selectivamente a Protactínio protactinium sais de metal que é, em seguida, extraiu-se a partir do ciclo de sal fundido, e de bismuto é meramente um veículo. É escolhido por causa de seu baixo ponto de fusão (271 ° C), baixa pressão de vapor, boa solubilidade para lítio e actinídeos, e imiscibilidade com fundido halogenetos.
Preparação

Antes do advento dos reactores nucleares, protactinium foi separada para experimentos científicos de minérios de urânio. Hoje em dia, é sobretudo produzido como um produto intermediário de fissão nuclear em reatores de alta temperatura de tório:
- Os horários são semi-vidas.
Protactínio metal pode ser preparado através da redução da sua flúor com fluoreto de cálcio, lítio ou bário a uma temperatura de 1300-1400 ° C.
Propriedades físicas e químicas
Protactínio é um dos actinídeos , que está posicionado na tabela periódica à esquerda de urânio e para a direita de tório , e muitas das suas propriedades físicas são intermediários entre aqueles dois actinídeos. Assim, Protactínio é mais densa e rígida de tório, mas é mais leve do que o urânio e o seu ponto de fusão é inferior à de tório e mais elevada do que a de urânio. A expansão térmica, condutividade elétrica e térmica desses três elementos são comparáveis e são típicos de "metais pobres". A estimativa módulo de cisalhamento de Protactínio é semelhante ao de titânio . Protactinium é um metal com brilho cinza-prateado que é preservado por algum tempo no ar. Protactínio facilmente reage com o oxigénio, vapor de água e aos ácidos, mas não com metais alcalinos.
À temperatura ambiente, protactinium cristaliza em centrada corpo- estrutura tetragonal que pode ser considerado como distorcida rede cúbica de corpo centrado; esta estrutura não muda por compressão até 53 GPa. As mudanças na estrutura para enfrentar centrado cúbico (FCC) mediante arrefecimento de alta temperatura, a cerca de 1200 ° C. O coeficiente de expansão térmica da fase tetragonal entre a temperatura ambiente e 700 ° C é de 9,9 x 10 -6 / ° C.
Protactinium é paramagnéticas transições magnéticas e não são conhecidos para isso a qualquer temperatura. Ele se torna supercondutor em temperaturas abaixo de 1,4 K. Protactinium tetracloreto é paramagnética à temperatura ambiente, mas voltas ferromagnético após arrefecimento até 182 K.
Protactínio existe em duas principais estados de oxidação , 4 e 5, ambos em sólidos e soluções, e as três e dois estados foram observadas em algumas fases sólidas. Como a configuração eletrônica do átomo neutro é [Rn] 7s 6d 2 1 2 5-F, o estado de oxidação +5 corresponde à baixa energia (e, portanto, favorecida) 5F 0 configuração. Ambos os 4 e 5 estados formar facilmente hidróxidos na água com os iões predominantes sendo Pa (OH) 3+, Pa (OH) 2+
2, Pa (OH) +
3 e Pa (OH) 4, todos incolor. Outros íons protactinium conhecidos incluem PACL 2+
2, Paso 2+
4, o PAF 3+, 2+ PAF
2, PAF -
6, PAF 2-
7 e PAF 3-
8.
Os compostos químicos
| Fórmula | cor | simetria | grupo espacial | Não | Símbolo Pearson | A (pm) | b (pm) | c (h) | Z | Densidade, g / cm 3 |
|---|---|---|---|---|---|---|---|---|---|---|
| Pa | cinza-prateado | tetragonal | I4 / mmm | 139 | Ti2 | 392,5 | 392,5 | 323,8 | 2 | 15,37 |
| PaO | rocksalt | Fm 3 m | 225 | CF8 | 496,1 | 4 | 13,44 | |||
| PaO 2 | preto | FCC | Fm 3 m | 225 | CF12 | 550.5 | 4 | 10,47 | ||
| Pa 2 O 5 | branco | Fm 3 m | 225 | cF16 | 547,6 | 547,6 | 547,6 | 4 | 10,96 | |
| Pa 2 O 5 | branco | orthorhombic | 692 | 402 | 418 | |||||
| Pah 3 | preto | cúbico | Pm 3 n | 223 | CP32 | 664,8 | 664,8 | 664,8 | 8 | 10,58 |
| PAF 4 | marrom-vermelho | monoclinic | C2 / c | 15 | MS60 | 2 | ||||
| PACL 4 | verde-amarelo | tetragonal | I4 1 / amd | 141 | Ti20 | 837,7 | 837,7 | 748,1 | 4 | 4,72 |
| PaBr 4 | marrom | tetragonal | I4 1 / amd | 141 | Ti20 | 882,4 | 882,4 | 795,7 | ||
| PACL 5 | amarelo | monoclinic | C2 / c | 15 | mS24 | 797 | 1135 | 836 | 4 | 3.74 |
| PaBr 5 | vermelho | monoclinic | P2 1 / c | 14 | mP24 | 838,5 | 1.120,5 | 1.214,6 | 4 | 4.98 |
| PaOBr 3 | monoclinic | C2 | 1.691,1 | 387.1 | 933,4 | |||||
| Pa (PO3) 4 | orthorhombic | 696,9 | 895,9 | 1.500,9 | ||||||
| Pa 2 P 2 O 7 | cúbico | Pa3 | 865 | 865 | 865 | |||||
| Pa (C 8 H 8) 2 | amarelo-dourado | monoclinic | 709 | 875 | 1062 |
Aqui a, b e c são constantes de rede em picometros, n é o número do grupo de espaço e Z é o número de por unidades de fórmulas célula unitária; FCC representa o face-centrada simetria cúbica. Densidade não foi medido directamente mas calculadas a partir dos parâmetros de rede.
Óxidos e sais contendo oxigénio
Óxidos Protactinium são conhecidos para os estados de oxidação do metal 2, 4 e 5. O mais estável é o pentóxido branco Pa 2 O 5, o que pode ser produzida por meio da ignição Protactínio (V) em hidróxido de ar a uma temperatura de 500 ° C. A sua estrutura cristalina é cúbica, e a composição química é frequentemente não estequiométrica, como descrito PaO 2,25. Foi também relatada outra fase deste óxido com simetria ortorrômbica. O dióxido de preto PaO2 é obtido a partir do pentóxido reduzindo-o a 1550 ° C com hidrogénio. Ele não é facilmente solúvel em ou diluído ou concentrado nítrico , clorídrico ou ácido sulfúrico , mas dissolve-se facilmente em ácido fluorídrico. O dióxido podem ser convertidos de volta para pentóxido por aquecimento em atmosfera contendo oxigênio a 1100 ° C. O monóxido de PaO só foi observado como um revestimento fino sobre Protactínio de metal, mas não numa forma a granel isolado.
Formas Protactinium misturados óxidos binários com diversos metais. Com metais alcalinos A, os cristais têm uma fórmula química APAO 3 e estrutura perovskita, ou A 3 PaO 4 e estrutura de sal-gema distorcida, ou A 7 PaO 6, onde os átomos de oxigênio para um repleto de perto hexagonal. Em todos estes materiais, os iões protactinium são coordenadas octaedricamente. O pentóxido de Pa 2 O 5 combina-se com óxidos de metal de terras raras R 2 O 3 para formar vários óxidos mistos-nonstoichiometric, também da estrutura da perovsquita.
Óxidos são Protactinium de base; eles facilmente converter a hidróxidos e podem formar vários sais, tais como sulfatos , fosfatos, nitratos , etc. O nitrato é geralmente branca, mas pode ser marrom, devido à decomposição radiolítica. O aquecimento do nitrato em ar a 400 ° C, converte-lo para o pentóxido Protactínio branco. O polytrioxophosphate Pa (PO3) 4 pode ser produzido por reacção de difluoreto de sulfato de PAF 2 SO 4 com ácido fosfórico (H 3 PO 4), sob atmosfera de gás inerte. Aquecendo o produto a cerca de 900 ° C, elimina-se a reacção por produtos tais como ácido fluorídrico, de trióxido de enxofre e anidrido fosfórico. O aquecimento a temperaturas mais elevadas numa atmosfera inerte se decompõe Pa (PO 3) 4 em PAP difosfato 2 O 7, o qual é análogo ao de outros difosfatos actinídeos. No difosfato, os PO três grupos formam pirâmides de C 2v simetria. Aquecimento PaP 2 O 7 no ar a 1400 ° C decompõe em os pentoxides de fósforo e protactinium.
Halides
Protactinium (V) formas de fluoreto de cristais brancos, onde os íons protactinium estão dispostas em bipyramids pentagonais e coordenado por sete outros íons. A coordenação é a mesma em Protactínio (V) cloreto, mas a cor é amarelo. As alterações de coordenação octaédrica para o brometo de Protactínio castanho (V) e é desconhecido para Protactínio (V) de iodeto. A coordenação protactinium em todas as suas tetra é 8, mas o arranjo é antiprismatic praça em protactinium (IV) flúor e dodecaédrico no cloreto e brometo. Protactinium de cor castanha (III) de iodeto foi relatado onde os íons são protactinium 8 coordenados em um arranjo trigonal prismática bicapped.

Protactinium (V) flúor e protactinium (V) cloreto possuem uma estrutura polimérica de simetria monoclínica. Lá, dentro de uma cadeia polimérica, todos os átomos de iodetos mentir em um plano de grafite-like e formar pentágonos planas em torno dos íons protactinium. A coordenação 7 de protactinium tem origem nos 5 átomos de iodetos e duas ligações para átomos de protactinium pertencentes às cadeias nas proximidades. Estes compostos hidrolisam facilmente em água. O pentacloreto funde a 300 ° C e sublima a temperaturas ainda mais baixas.
Protactínio (V) de fluoreto pode ser preparado por reacção de óxido de Protactínio com qualquer bromo ou pentafluoride trifluoreto de bromo a cerca de 600 ° C, e Protactínio (IV) é obtido a partir de flúor o óxido e uma mistura de hidrogénio e fluoreto de hidrogénio a 600 ° C; um grande excesso de hidrogénio é necessária para remover o oxigénio atmosférico fugas na reacção.
Protactínio (V) de cloreto é preparado por reacção de óxido de Protactínio com tetracloreto de carbono à temperatura de 200-300 ° C. Os subprodutos (tais como PaOCl 3) são removidos por sublimação fraccionai. Redução de Protactínio (V) com cloreto de hidrogénio a cerca de 800 ° C produz Protactínio (IV) cloreto de - um sólido amarelo esverdeado que sublima sob vácuo a 400 ° C; ele também pode ser obtida directamente a partir de dióxido de Protactínio por tratamento com tetracloreto de carbono a 400 ° C.
Brometos Protactinium são produzidas pela acção de brometo de alumínio, brometo de hidrogénio, tetrabrometo de carbono ou uma mistura de brometo de hidrogénio e brometo de tionilo em óxido Protactínio. Uma reacção alternativa é entre pentacloreto Protactínio e brometo de hidrogénio ou brometo de tionilo. Protactínio (V) brometo tem duas formas monoclínica semelhantes, um é obtida por sublimação a 400-410 ° C e um outro por sublimação a um nível ligeiramente inferior temperatura de 390-400 ° C.
Iodetos Protactinium resultar a partir dos óxidos e iodeto de alumínio ou iodeto de amónio aquecida a 600 ° C. Protactínio (III) de iodeto foi obtido por aquecimento Protactínio (V) em iodeto de vácuo. Tal como com os óxidos, formas protactinium misturado com halogenetos de metais alcalinos. Entre estes, o mais notável é Na 3 PAF 8, onde ion protactinium é simetricamente cercado por 8 F - íons que formam um cubo quase perfeito.
Fluoretos protactinium mais complexos são também conhecidos, tais como 2 M Pa 9 e fluoretos ternárias dos tipos MPaF 6 (M = Li, Na, K, Rb, Cs ou NH4), H 2 PAF 7 (M = K, Rb, Cs ou NH 4) e M 3 PAF 8 (M = Li, Na, Rb, Cs), sendo todos sólidos cristalinos brancos. A fórmula MPaF 6 pode ser representada como uma combinação de MF e 5 PAF. Estes compostos podem ser obtidos por evaporação de uma solução de ácido fluorídrico contendo estes complexos ambos. Para os pequenos cátions alcalinos como Na, a estrutura cristalina é tetragonal, enquanto abaixa para orthorphombic para maiores cátions K +, + Rb, Cs + ou NH 4 +. Uma variação semelhante foi observado para as M 2 PAF 7 fluoretos, ou seja, a simetria do cristal era dependente do catião e distinta para Cs 2 PAF 7 e H 2 PAF 7 (M = K, Rb ou NH 4).
Outros compostos inorgânicos
Oxihaletos e oxissulfuretos de protactinium são conhecidos. PaOBr 3 tem uma estrutura monoclínica composto por unidades de cadeia dupla, onde protactinium tem coordenação 7 e está organizada em bipyramids pentagonais. As cadeias são interligadas através de átomos de oxigénio e bromo, e cada átomo de oxigénio está relacionado com três átomos de Pa. PAO é um sólido não-volátil de cor amarela clara com uma rede cristalina cúbica isoestrutural com a de outros oxissulfuretos actinídeos. Obtém-se por reacção de Protactínio (V) com uma mistura de cloreto de sulfureto de hidrogénio e dissulfureto de carbono a 900 ° C.
Em hidretos e nitretos, protactinium tem um baixo estado de oxidação de cerca de 3. O hidreto é obtido por acção directa de hidrogénio sobre o metal a 250 ° C, e o nitreto é um produto de amoníaco e tetracloreto de Protactínio ou pentacloreto. Este sólido amarelo brilhante é estável ao aquecimento a 800 ° C em vácuo. Protactínio carboneto de PAC é formado por redução de tetrafluoreto de Protactínio com bário em um cadinho de carbono a uma temperatura de cerca de 1400 ° C. Protactinium formas que incluem borohidretos Pa (BH 4) 4. Ele tem uma estrutura polimérica não usual com cadeias helicoidais em que o átomo de Protactínio tem o número de coordenação de 12 e está rodeado por seis BH 4 - iões.

Os compostos organometálicos
Protactínio (IV) forma um complexo tetraquis (ciclopentadienil) Protactínio tetraédrico (IV) (ou Pa (C 5 H 5) 4) com quatro anéis de ciclopentadienilo, que pode ser sintetizados por reacção de Protactínio (IV) com cloreto de fundido ser (C 5 H 5) 2. Um anel pode ser substituído com um átomo de halogeneto. Outro complexo organometálico é bis amarelo-douradas (π-ciclooctatetraeno) Protactínio, Pa (C 8 H 8) 2, que é análoga em estrutura a uranocene. Lá, o átomo de metal é imprensada entre dois ligantes cyclooctatétraène. Semelhante a uranocene, ele pode ser preparado fazendo reagir tetracloreto de Protactínio com dipotássico cyclooctatetraenide, K 2 C 8 H 8, em tetra-hidrofurano.
Isótopos
Vinte e nove radioisótopos de Protactínio foram descobertos, os mais estáveis 231 Pa com uma meia-vida de 32.760 anos, 233 Pa, com uma meia-vida de 27 dias, e 230 Pa, com uma semi-vida de 17,4 dias. Todos os isótopos restantes têm semi-vidas mais curtas do que 1,6 dias, e a maioria delas têm uma meia-vida inferiores a 1,8 segundo. Protactinium também tem dois isómeros nucleares, 217m Pa (semi-vida de 1,2 milissegundos) e 234m Pa (meia-vida de 1,17 minutos).
O primário modo de decaimento para os isótopos de Protactínio mais leve do que (e incluindo) o isótopo mais estável 231 Pa (ou seja, 212 Pa a 231 Pa) é decaimento alfa eo primeiro modo para os isótopos mais pesados (ou seja, 232 a 240 Pa Pa) é decaimento beta. O primário produtos de decaimento de isótopos de protactinium mais leve do que (e incluindo) 231 Pa são actinium isótopos e os primeiros produtos de decaimento dos isótopos mais pesados de protactinium são urânio isótopos.
Aplicações
Embora protactinium está localizado na tabela periódica entre urânio e tório, que ambos têm inúmeras aplicações, devido à sua escassez, alta radioatividade e alta toxicidade, não há atualmente nenhum uso para o protactínio fora da investigação científica.
Protactinium-231 surge do decaimento do urânio-235 formados em reatores nucleares, e pela reacção 232 Th + n → 231 Th + 2 N e subsequente decaimento beta. Pode suportar uma reação nuclear em cadeia, o que poderia, em princípio, ser usado para construir armas nucleares . O físico Walter Seifritz uma vez estimado o associado massa crítica como 750 ± 180 kg, mas esta possibilidade (de uma reação em cadeia) foi descartada por outros físicos nucleares desde então.
Com o advento da altamente sensíveis espectrômetros de massa , uma aplicação de 231 Pa como traçador em geologia e Paleoceanography tornou-se possível. Assim, a proporção de Protactínio-231 de tório-230 é usado para datação radiométrica de sedimentos que são até 175 mil anos de idade e na modelagem da formação dos minerais. Em particular, a sua avaliação em sedimentos oceânicos permitiu reconstruir os movimentos do Atlântico Norte massas de água durante a última fusão de A Era do Gelo geleiras . Algumas das variações relacionadas com o protactinium namoro confiar na análise das concentrações relativas de vários membros de vida longa da cadeia de decaimento do urânio - urânio, tório e protactinium, por exemplo. Estes elementos têm 6, 5 e 4 F-elétrons na camada externa e, assim, favorecer seis, cinco e quatro estados de oxidação, respectivamente, e mostram diferentes propriedades físicas e químicas. Então, tório e protactinium, mas não compostos de urânio são pouco solúveis em soluções aquosas, e precipitar em sedimentos; a taxa de precipitação é mais rápido do que no caso do tório para protactinium. Além disso, a análise da concentração, tanto para Protactínio-231 (semi-vida de 32.750 anos) e tório-230 (semi-vida de 75.380 anos) permite melhorar a precisão em comparação com quando apenas um isótopo é medido; este método de duplo isótopo também é fracamente sensíveis à falta de homogeneidade na distribuição espacial dos isótopos e a variações na sua taxa de precipitação.
Precauções
Protactinium é tanto tóxico e altamente radioativo e, portanto, todas as manipulações com que são realizados em uma selada porta-luvas. Sua principal isótopo 231 Pa tem uma actividade específica de 0,048 Ci / grama e emite partículas alfa, principalmente da energia 5 MeV, que pode ser interrompido por uma camada fina de qualquer material. No entanto, ele decai lentamente, com a meia-vida de 32.760 anos, em 227 AC, que tem uma actividade específica de 74 Ci / grama, emite tanto alfa e beta de radiação, e tem uma meia-vida de 22 anos muito mais curto. 227 Ac, por sua vez, decai para isótopos mais leves, com ainda mais curtas semi-vidas e as actividades específicas muito maiores (SA), conforme resumido na tabela abaixo.
| Isótopo | 231 Pa | 227 Ac | 227 Th | 223 Ra | 219 Rn | 215 Po | 211 Pb | 211 Bi | 207 Tl |
|---|---|---|---|---|---|---|---|---|---|
| SA ( Ci / g) | 0,048 | 73 | 3,1 x 10 4 | 5,2 x 10 4 | 1,3 x 10 10 | 3 × 10 13 | 2,5 x 10 7 | 4,2 x 10 8 | 1,9 x 10 8 |
| Decadência | α | α, β | α | α | α | α | β | α, β | β |
| Meia-vida | 33 ka | 22-A | 19 dias | 11 dias | 4 s | 1,8 ms | 36 min | 2,1 min | 4,8 min |
Como Protactínio está presente em pequenas quantidades na maioria dos produtos naturais e de materiais, que é ingerido com alimentos ou na água e com o ar inalado. Apenas cerca de 0,05% de Protactínio ingerido é absorvido no sangue e o restante é excretado. A partir do sangue, cerca de 40% dos depósitos protactinium nos ossos, cerca de 15% vai para o fígado, de 2% para os rins, e o restante sai do corpo. A meia-vida biológica de Protactínio é cerca de 50 anos nos ossos, enquanto que em outros órgãos a cinética tem um componente rápida e lenta. Assim, no fígado 70% de Protactínio ter uma meia-vida de 10 dias e 30% permanecer durante 60 dias. Os valores correspondentes para os rins são 20% (10 dias) e 80% (60 dias). Em todos estes órgãos, protactinium promove o câncer através da sua radioatividade. A dose máxima de segurança do Pa no corpo humano é de 0,03 uCi que corresponde a 0,5 microgramas de 231 Pa. Este isótopo é de 2,5 × 10 8 vezes mais tóxico do que o ácido cianídrico . As concentrações máximas permitidas de 231 Pa no ar é de 3 × 10 -4 Bq / m 3.
![\ Mathrm {^ {232} _ {\ 90} Th \ + \ ^ _ {1} {0} n \ \ longrightarrow \ ^ {233} _ {\ 90} Th \ \ xrightarrow [22.3 \ min] {\ beta ^ -} \ ^ {233} _ {\} 91 Pa \ \ xrightarrow [26,967 \ d] {\ beta ^ -} \ ^ {233} _ {\ 92} U}](../../images/2279/227997.png)
