
Ósmio
Fundo para as escolas Wikipédia
Crianças SOS, que corre cerca de 200 sos escolas no mundo em desenvolvimento, organizado esta selecção. Veja http://www.soschildren.org/sponsor-a-child para saber mais sobre apadrinhamento de crianças.
| Ósmio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Os 76 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
prateado, azul elenco  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | ósmio, Os, 76 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / ɒ z m Eu ə m / OZ -mee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria elemento | de metal de transição | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | 8, 6, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | 190,23 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Xe ] 4f 14 5d 6 6s 2 2, 8, 18, 32, 14, 2 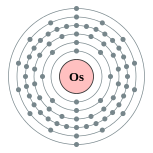 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| História | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descoberta | Smithson Tennant (1803) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primeiro isolamento | Smithson Tennant (1803) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 22,59 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidade no pf | 20 g cm -3 · | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 3306 K , 3033 ° C, 5491 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 5285 K, 5012 ° C, 9054 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusão | 57.85 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporização | 738 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 24,7 J · · mol -1 K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 8, 7, 6, 5, 4, 3, 2, 1, 0, -1, -2 (Moderadamente ácida óxido) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 2,2 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização | 1º: 840 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Segunda: 1600 kJ mol -1 · | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atômico | 135 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 144 ± 16:00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | hexagonal repleto de perto | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | paramagnético | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistividade elétrica | (0 ° C) 81,2 Nco · m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 87,6 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Expansão térmica | (25 ° C) 5.1 uM · · K -1 m -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C) 4940 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de cisalhamento | 222 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa de módulo | 462 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rácio de Poisson | 0,25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 3920 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-04-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de ósmio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ósmio é um elemento químico com o símbolo Os e número atômico 76. É um duro, frágil, branco-azulada metal de transição no família da platina e é mais denso do elemento que ocorre naturalmente, com uma densidade de 22,59 g / cm 3. É encontrada naturalmente na forma de uma liga, na sua maioria em minérios de platina; sua ligas com platina , irídio , e outros metais do grupo da platina são empregues em caneta dicas fonte, contatos elétricos e outras aplicações onde extrema durabilidade e dureza são necessários.
Características
Propriedades físicas

Ósmio tem uma tonalidade azul-cinzento e é o mais denso elemento estável, ligeiramente mais denso que o irídio . Cálculos de densidade a partir da Dados de difração de raios-X podem produzir os dados mais confiáveis para estes elementos, dando um valor de 22,562 ± 0,009 g / cm 3 para o irídio contra 22,587 ± 0,009 g / cm3 para o ósmio. A alta densidade de ósmio é uma consequência da contração dos lantanídeos.
Ósmio é um duro, mas frágil de metal que permanece lustrosa mesmo a altas temperaturas. Tem um muito baixo compressibilidade. Correspondentemente, a sua módulo de volume é extremamente alta, relatada entre 395 e 462 GPa, que rivaliza com a de diamante (443 GPa). A dureza de ósmio é moderadamente elevada a 4 GPa. Devido à sua dureza, fragilidade, baixa pressão de vapor (o menor dos metais do grupo da platina), e muito alto ponto de fusão (o quarta maior de todos os elementos), ósmio sólido é difícil de máquina, forma ou de trabalho.
Propriedades químicas
| Estados de oxidação do tetróxido | |
|---|---|
| -2 | Na 2 [Os (CO) 4] |
| -1 | Na 2 [Os 4 (CO) 13] |
| 0 | Os 3 (CO) 12 |
| +1 | OSI |
| 2 | OSI 2 |
| 3 | OsBr 3 |
| 4 | OsO 2, OsCl 4 |
| 5 | OSF 5 |
| 6 | OSF 6 |
| +7 | OSOF 5, OSF 7 |
| 8 | OsO4, Os (NCH 3) 4 |
Ósmio forma compostos com estados de oxidação que variam de -2 a 8. Os estados de oxidação mais comuns são 2, 3, 4, e 8. O estado de oxidação 8 é notável por ser o mais alto alcançado por qualquer elemento químico, e para além de ósmio, é encontrado apenas em xenon , rutênio , hassium , irídio , e plutônio (instável). Os estados de oxidação -1 e -2 representados pelos dois compostos reactivos de Na 2 [OS 4 (CO) 13] e Na 2 [Ss (CO) 4] são utilizados na síntese de ósmio compostos cluster.
O composto mais comum exibindo o estado de oxidação é +8 tetróxido de ósmio. Este composto tóxico é formado quando o ósmio em pó é exposto ao ar, e é um cristalino muito volátil, solúvel em água, amarelo pálido, sólido, com um cheiro forte. Ósmio em pó tem o cheiro característico de tetróxido de ósmio. Formas tetróxido de ósmio osmates vermelhas OsO 4 (OH) 2-
2 após reacção com uma base. Com amônia, que forma os nitrido-osmates OSO 3 N -. Tetróxido de ósmio entra em ebulição a 130 ° C e é um poderoso agente oxidante. Por contraste, dióxido de ósmio (OsO 2) é preto, não volátil, e muito menos reactivo e tóxico.
Apenas dois compostos de ósmio têm importantes aplicações: tetróxido de ósmio para tecido de coloração em microscopia electrónica e para a oxidação de alcenos em síntese orgânica, e os osmates não-voláteis para reacções de oxidação orgânicas.
Heptafluoride ósmio (OSF 7) e pentafluoreto de ósmio (OSF 5) são conhecidos, mas trifluoreto de ósmio (OSF 3) ainda não tenha sido sintetizada. Os estados de oxidação mais baixos são estabilizadas pelos halogéneos maiores, de modo que o tricloreto, tribrometo de boro, tri-iodeto, e mesmo diiodeto são conhecidos. O estado de oxidação +1 é conhecido apenas por iodeto de ósmio (OSI), ao passo que vários complexos carbonílicos de ósmio, tais como dodecacarbonyl triosmium (Os 3 (CO) 12), representam estado de oxidação 0.
Em geral, os estados de oxidação mais baixos de ósmio são estabilizadas pela ligandos que são bons σ-doadores (por exemplo, aminas ) e aceitadores (π- heterociclos contendo azoto ). Os estados de oxidação mais elevados são estabilizados por uma forte σ- e π-doadores, tais como S e N 2- 3-.
Isótopos
Osmium tem sete ocorrem naturalmente isótopos , seis dos quais são estáveis: 184 OS, 187 OS, 188 OS, 189 OS, 190 OS, e (mais abundante) 192 Os 186 Os sofre. decaimento alfa com uma longa tais meia-vida ((2,0 ± 1,1) x 10 15 anos) que, para fins práticos, pode ser considerada estável. Decaimento alfa está previsto para todos os sete isótopos que ocorrem naturalmente, mas devido a muito longas semi-vidas, que foi observada apenas para 186 Os. Prevê-se que 184 192 Os e Os pode sofrer decaimento beta duplo, mas esta radioatividade não foi observado ainda.
Os 187 é a filha do 187 Re (meia-vida de 4,56 × 10 10 anos) e é usado extensivamente em namoro terrestre, bem como meteóricas rochas (veja datando rênio-ósmio). Também tem sido utilizado para medir a intensidade da resistência ao longo do tempo geológico continental e fixar idades mínimas para a estabilização do manto de raízes continentais crátons . Esta deterioração é uma razão pela qual os minerais ricos em rênio são anormalmente rica em 187 Os. No entanto, a aplicação mais notável de Os em que data tem sido conjugado com irídio, para analisar a camada de quartzo chocado ao longo da Limite Cretáceo-Paleogene que marca a extinção dos dinossauros 65 milhões de anos.
História
Ósmio (do grego osme (ὀσμή) que significa "cheiro") foi descoberto em 1803 por Smithson Tennant e William Hyde Wollaston em Londres , Inglaterra . A descoberta de ósmio está entrelaçada com a da platina e outros metais do grupo da platina. Platinum chegou à Europa como platina ("pequena prata"), encontrou pela primeira vez no final do século 17 em minas de prata ao redor do Departamento de Chocó, na Colômbia . A descoberta de que este metal não era uma liga, mas um novo elemento distinto, foi publicado em 1748. Os químicos que estudaram platina dissolveu em água régia (uma mistura de clorídrico e ácido sulfúrico e nítrico ) para criar os sais solúveis. Eles sempre observada uma pequena quantidade de um resíduo escuro, insolúvel. Joseph Louis Proust pensou que o resíduo era grafite. Victor Collet-Descotils, Antoine François, conde de Fourcroy, e Louis Nicolas Vauquelin também observada se o resíduo negro em 1803, mas não se obter material suficiente para outras experiências.
Em 1803, Smithson Tennant analisou o resíduo insolúvel e concluiu que ele deve conter um novo metal. Vauquelin tratado o pó alternadamente com álcalis e ácidos e obteve um novo óxido volátil, o que ele acreditava ser deste novo metal que ele chamou ptene, a partir da palavra grega πτηνος (ptènos) para alado. No entanto, Tennant, que tinha a vantagem de uma quantidade muito maior de resíduo, continuou sua pesquisa e identificou dois elementos previamente não descobertos no resíduo preto, irídio e ósmio. Ele obtido uma solução amarela (provavelmente de cis - [Ss (OH) 2 O 4] 2-) por reacção com hidróxido de sódio em calor vermelho. Após acidificação ele foi capaz de destilar o OsO formada 4. Ele nomeou ósmio após grego significado osme "um cheiro", por causa do cheiro pálido e smoky do volátil tetróxido de ósmio. Descoberta de novos elementos foi documentado em uma carta ao Royal Society em 21 de junho de 1804.
Urânio e ósmio foram catalisadores iniciais bem sucedidas no Processo Haber, a fixação de nitrogênio reação de nitrogênio e hidrogênio para produzir amônia , dando um rendimento suficiente para tornar o processo economicamente bem sucedido. No momento, um grupo em BASF liderada por Carl Bosch comprou a maioria do abastecimento mundial de ósmio para usar como um catalisador. Pouco tempo depois, em 1908, mais baratas catalisadores baseados em óxidos de ferro e de ferro foram introduzidas pelo mesmo grupo para as primeiras instalações piloto, eliminando a necessidade de o ósmio caro e raro.
Hoje em dia ósmio é obtido principalmente a partir do processamento de platina e níquel minérios.
Ocorrência

Ósmio é a elemento estável abundante menos na Terra crosta com uma fração de massa média de 0,05 ppb na crosta continental .
Ósmio é encontrado na natureza como de um elemento ou não combinado na naturais ligas; especialmente as ligas de irídio-ósmio, osmirídio (ósmio rico), e iridiosmium (irídio rico). Nos níquel e cobre os depósitos, os metais do grupo da platina como ocorrer sulfetos (ou seja, (Pt, Pd) S)), teluretos (por exemplo, PtBiTe), antimonides (por exemplo, PdSb), e arsenietos (por exemplo, PTAs 2); em todos estes compostos de platina é trocada por uma pequena quantidade de irídio e ósmio. Tal como acontece com todos os metais do grupo da platina, ósmio pode ser encontrado naturalmente em ligas com níquel ou cobre.
Dentro da crosta terrestre, ósmio, como o irídio, é encontrado em maiores concentrações em três tipos de estrutura geológica: depósitos ígneas (intrusões crosta de abaixo), crateras de impacto, e depósitos retrabalhadas a partir de um dos ex-estruturas. As maiores reservas conhecidas primárias estão no Complexo ígneo Bushveld na África do Sul , embora os grandes depósitos de cobre-níquel próximos Norilsk na Rússia , eo Bacia Sudbury no Canadá também são fontes significativas de ósmio. Reservas menores podem ser encontrados nos Estados Unidos. O depósitos aluviais usados por povo pré-colombiano no Departamento de Chocó, Colômbia ainda são uma fonte de metais do grupo da platina. A segunda grande depósito aluvial foi encontrado no Montes Urais, na Rússia, que ainda está minada.
Produção

Ósmio é obtido comercialmente como um subproduto de níquel e de cobre de mineração e de processamento. Durante electrolítica de cobre e níquel, metais nobres tais como a prata, ouro e os metais do grupo da platina, em conjunto com elementos não-metálicos tais como o selénio e telúrio assentar no fundo da célula como lama ânodo, o qual forma o material de partida para a sua extracção. De modo a separar os metais, devem primeiro ser posto em solução. Vários métodos estão disponíveis, dependendo do processo de separação e a composição da mistura; dois métodos representativos são fusão com peróxido de sódio, seguido por dissolução em água régia e dissolução numa mistura de cloro com ácido clorídrico . Ósmio, ruténio, ródio e irídio podem ser separados a partir de metais de platina, de ouro e de base pela sua insolubilidade em água régia, deixando um resíduo sólido. O ródio pode ser separado a partir do resíduo por meio de tratamento com fundido bissulfato de sódio. O resíduo insolúvel, contendo Ru, Os e Ir, é tratada com óxido de sódio, em que Ir é insolúvel, produzindo Ru e ósmio sais solúveis em água. Após oxidação para os óxidos voláteis, RuO 4 é separada da OsO4 por precipitação de (NH4) RuCl 3 6 com cloreto de amónio.
Depois dissolve-se, de ósmio é separado dos outros metais do grupo da platina por meio de destilação ou de extracção com solventes orgânicos do tetróxido de ósmio volátil. O primeiro método é semelhante ao procedimento utilizado por Tennant e Wollaston. Ambos os métodos são adequados para produção em escala industrial. Em ambos os casos, o produto é reduzido utilizando hidrogénio, obtendo-se o metal como um pó ou uma esponja que pode ser tratada usando técnicas da metalurgia dos pós.
Nem os produtores nem o Serviço Geológico dos Estados Unidos publicou quaisquer valores de produção para ósmio. Estimativas da data consumo dos Estados Unidos publicou desde 1971, o que dá um consumo nos Estados Unidos de 2000 onças (62 kg), sugere que a produção ainda menos do que 1 tonelada por ano.
Aplicações
Devido à volatilidade e à toxicidade do extremo do seu óxido de ósmio é raramente utilizado no seu estado puro, e em vez disso é muitas vezes misturado com outros metais. Essas ligas são utilizadas em aplicações de alto desgaste. Ligas de ósmio tais como o osmirídio são muito difícil e, juntamente com outros metais do grupo da platina, são utilizados nas pontas dos canetas, pivôs de instrumentos, e os contatos elétricos, como eles podem resistir ao desgaste de operação freqüente. Eles também foram usadas para as pontas de fonógrafo styli durante a tarde 78 rpm e cedo " LP "e" 45 "era registro, por volta de 1945 a 1955. Embora muito durável em comparação com agulha de aço e cromo pontos, dicas de liga leve de ósmio usavam para fora muito mais rapidamente do que o concorrente, mas mais caro safira e diamante dicas e foram interrompidas.
Tetróxido de ósmio foi usado em detecção de impressões digitais e na coloração tecido adiposo e para óptica microscopia eletrônica. Como um oxidante forte, ligações cruzadas lípidos, principalmente por meio de reacção com ligações insaturadas de carbono-carbono, e, assim, ambas as correções de membranas biológicas no lugar em amostras de tecidos e simultaneamente cora eles. Porque os átomos de ósmio são extremamente elétron denso, de coloração ósmio aumenta muito o contraste da imagem na A microscopia electrónica de transmissão (TEM) estudos de materiais biológicos. Esses materiais de carbono têm de outro modo muito fraco contraste TEM (ver imagem). Outro composto o ósmio, o ferricianeto de ósmio (OsFeCN), exibe fixação semelhante e acção corante.
O tetróxido e um composto relacionado, osmato de potássio, são oxidantes importantes para a síntese química, apesar de ser muito venenosos. Para o Di-hidroxilação assimétrica de Sharpless, que utiliza osmato para a conversão de um ligação dupla em um vicinal diol, Karl Barry Sharpless ganhou o Prêmio Nobel de Química em 2001. Aparentemente, OsO4 é muito caro para este uso, por isso KMnO4 é frequentemente usado em vez disso, mesmo que os rendimentos são menos para este reagente químico mais barato.
Em 1898, um químico austríaco, Auer von Welsbach, desenvolveu o Oslamp com um filamento feito de ósmio, que ele introduziu comercialmente em 1902. Depois de apenas alguns anos, o ósmio foi substituído pelo metal mais estável tungstênio . O tungstênio tem o ponto mais alto de qualquer metal de fusão, e usá-lo em lâmpadas aumenta a eficácia luminosa e vida útil das lâmpadas incandescentes.
O fabricante lâmpada Osram (fundada em 1906, quando três empresas alemãs, Auer-Gesellschaft, AEG e Siemens & Halske, combinaram suas instalações de produção da lâmpada) derivou seu nome a partir dos elementos de mio OS e Wolf ram (o último é alemão para tungstênio).
Como paládio, ósmio em pó absorve efetivamente átomos de hidrogênio. Isso poderia fazer ósmio um potencial candidato para um eletrodo de bateria de hidreto de metal. No entanto, o ósmio é caro e iria reagir com hidróxido de potássio, o electrólito mais comum da bateria.
Ósmio tem uma elevada reflectividade no ultravioleta do intervalo espectro eletromagnético; por exemplo, a 600 Â ósmio tem uma reflectividade que duas vezes de ouro. Esta alta refletividade é desejável em base espaço- Espectrômetros UV que reduziram o tamanho dos espelhos, devido a limitações de espaço. Espelhos revestidas de ósmio voaram várias missões espaciais a bordo da Vaivém espacial, mas logo ficou claro que os radicais de oxigênio no órbita baixa da terra são abundantes o suficiente para deteriorar significativamente a camada de ósmio.
O uso clínico único conhecido de ósmio parece ser para synovectomy em pacientes com artrite na Escandinávia. Ela envolve a administração local de tetróxido de ósmio (OsO4), que é um composto altamente tóxico. A falta de relatos de efeitos colaterais a longo prazo sugerem que a própria ósmio pode ser biocompatível, embora isto dependa do composto administrado de ósmio. Em 2011, o ósmio (VI) e ósmio (II) compostos foram relatados para mostrar a atividade anticâncer in vivo, indicou um futuro promissor para a utilização de compostos de ósmio como drogas anticâncer.

Eletromicrografia de (orgânica) de tecidos de plantas sem (em cima) e com (parte inferior) OSO4 coloração
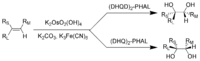
O dihidroxilação Sharpless:
R L = maior substituinte; R M = substituinte de médio porte; R S = Menor substituinte
Aparência pós-voo de Os, Ag, Au e espelhos de frente (imagens esquerda) e posterior do Space Shuttle. Escurecimento revela oxidação devido à irradiação por átomos de oxigênio.
Precauções
Ósmio metálico finamente dividido é pirofórico. Ósmio reage com o oxigênio à temperatura ambiente formando volátil tetróxido de ósmio. Alguns compostos de ósmio também são convertidos para o tetróxido se o oxigénio está presente. Isso faz com que o tetróxido de ósmio a principal fonte de contacto com o meio ambiente.
Tetróxido de ósmio é altamente volátil e penetra na pele facilmente, e é muito tóxico por inalação, ingestão e contacto com a pele. Baixas concentrações na atmosfera de vapor de ósmio pode causar congestão pulmonar e ou pele danos oculares, e deve, portanto, ser utilizado numa hotte. Tetróxido de ósmio é rapidamente reduzido a compostos relativamente inertes, de óleos vegetais poli-insaturados, tais como óleo de milho .
Preço
Ósmio normalmente é vendido como um pó puro de 99%. À semelhança de outros metais preciosos, que é medida por peso troy e por gramas. Seu preço em 2010 foi de cerca de US $ 400 por onça troy (ou cerca de US $ 13 por grama), dependendo da quantidade e do seu fornecedor.
