
Criptônio
Sobre este escolas selecção Wikipedia
Crianças SOS tentou tornar o conteúdo mais acessível Wikipedia por esta selecção escolas. SOS mães cada um cuidar de uma família de crianças apadrinhadas .
| Criptônio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
36 Kr | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
gás incolor, exibindo um brilho esbranquiçado em um campo elétrico de alta  Linhas espectrais de criptônio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | criptônio, Kr, 36 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / k r ɪ p t ɒ n / Krip -ton | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria elemento | gases nobres | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | 18 (gases nobres) , 4, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | 83,798 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Ar ] 3d 10 4s 2 4p 6 2, 8, 18, 8 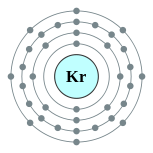 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| História | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descoberta | William Ramsay e Morris Travers (1898) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primeiro isolamento | William Ramsay e Morris Travers (1898) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | gás | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade | (0 ° C, 101,325 kPa) 3,749 g / L | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidade no pb | 2.413 g cm -3 · | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 115,79 K , -157,36 ° C, -251,25 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 119,93 K, -153,22 ° C, -244,12 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto Triplo | 115,775 K (-157 ° C), 73,2 kPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto crítico | 209,41 K, 5,50 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusão | 1.64 kJ mol -1 · | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporização | 9,08 kJ mol -1 · | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 5 R / 2 = 20,786 J · · mol -1 K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 2, 1, 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 3,00 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização | 1º: 1350,8 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2: 2350,4 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3: 3565 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 116 ± 16:00 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals raio | 202 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | cúbica de face centrada  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | diamagnetic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 9,43 x 10 -3 W · · K -1 m -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som | (Gás, 23 ° C) 220, (líquido) 1120 m · s -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7439-90-9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de criptônio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Krypton (do grego : κρυπτός kryptos "o oculto") é um elemento químico com o símbolo Kr e número atômico 36. Ele é um membro do grupo 18 (gases nobres) elementos. A incolor, inodoro, insípido gás nobre , criptônio ocorre em quantidades vestigiais na atmosfera , é isolado por destilação fracionada do ar liquefeito, e é muitas vezes usado com outros gases raros em lâmpadas fluorescentes. Krypton é inerte para fins mais práticos.
Krypton, como os outros gases nobres , pode ser utilizada na iluminação e fotografia. Krypton luz tem um grande número de linhas espectrais, e saída de luz elevada de crípton em plasmas lhe permite desempenhar um papel importante em muitos lasers de alta potência de gás (ião crípton e excimer laser), o que escolher para fora uma das muitas linhas espectrais para amplificar. Há também uma específica krypton laser de fluoreto. A alta potência e relativa facilidade de operação dos tubos de descarga krypton causadas (1960-1983) o comprimento de um oficial metros para ser definido em termos do 605 nm (vermelho-laranja) linha espectral de crípton-86.
História

Krypton foi descoberto na Grã-Bretanha em 1898 por Sir William Ramsay, um químico escocês, e Morris Travers, um químico Inglês, no resíduo da evaporação quase todos os componentes do ar líquido. Neon foi descoberto por um procedimento semelhante pelos mesmos trabalhadores apenas algumas semanas mais tarde. William Ramsay foi premiado com o 1904 Prêmio Nobel de Química pela descoberta de uma série de gases nobres , incluindo krypton.
Em 1960, um acordo internacional definido o medidor em termos de comprimento de onda de luz emitida pelo isótopo crípton-86 (comprimento de onda de 605,78 nanómetros). Este acordo substituiu o medidor padrão de longa data localizado em Paris , que foi uma barra de metal feita de um de platina - irídio liga (o bar foi originalmente estimado em um décimo milionésimo de um quadrante da Terra circunferência polar 's), e foi-se substituído por uma definição com base na velocidade da luz - uma constante física fundamental. No entanto, em 1927, o Conferência Internacional de Pesos e Medidas tinha redefiniu o metro em termos de uma linha espectral vermelho cádmio (1 m = 1,553,164.13 comprimentos de onda). Em Outubro de 1983, o mesmo bureau definiu o metro como a distância que a luz viaja em um vácuo durante 1 / 299.792.458 s.
Características
Crípton é caracterizado por várias linhas de emissão afiados ( assinaturas espectrais) o verde mais forte estar e amarelo. É um dos produtos de urânio fissão . solidificados crípton é branco e cristalino com um centrada face cúbico estrutura de cristal, que é uma propriedade comum de todos os gases nobres (exceto hélio, com uma estrutura de cristal cheio de perto hexagonal).
Isótopos
De ocorrência natural crípton é feito de seis estáveis isótopos. Além disso, cerca de trinta e isótopos instáveis isómeros são conhecidos. Cr 81, o produto das reacções atmosféricas, é produzido com os outros que ocorrem naturalmente isótopos de crípton. Ser radioactivos, que tem uma meia-vida de 230.000 anos. Krypton é altamente volátil quando está perto as águas de superfície, mas 81 Kr foi usado para a datação de idade (50,000-800,000 anos) águas subterrâneas.
85 Kr é um gás nobre inerte radioactivo com uma semi-vida de 10,76 anos. É produzido pela fissão de urânio e plutónio , tal como na bomba nuclear e ensaios reatores nucleares. 85 Kr é liberado durante o reprocessamento de barras de combustível de reatores nucleares. As concentrações no Pólo Norte são 30% mais elevados do que na Pólo Sul devido à mistura convectiva.
Química
Como os outros gases nobres, criptônio é quimicamente inerte. No entanto, após a primeira síntese bem sucedida de xénon em 1962 compostos, a síntese de crípton difluoreto (KrF 2) foi relatada em 1963. No mesmo ano, KrF 4 foi relatado por Grosse et ai., mas foi subsequentemente demonstrado ser uma identificação errada. Há também relatos não confirmados de um bário sal de um krypton oxoácido. Ar Kr + e Kr H + íons poliatómicos foram investigados e há evidências de Kr Xe ou KrXe +.
Os compostos com crípton ligados a outros átomos de flúor têm também sido descobertas. A reação de KrF 2 com B (OTeF 5) 3 produz um composto instável, Kr (OTeF 5) 2, que contém uma ligação krypton-oxigênio. Uma ligação krypton-nitrogênio é encontrado no cátion [HC≡N-Kr-F] +
, Produzido pela reacção de KrF com 2 [HC≡NH] +
[AsF -
6] abaixo de -50 ° C. HKrCN e HKrC≡CH (krypton-hidreto de cianeto e hydrokryptoacetylene) foram relatados para ser estável até 40 K .
Ocorrência natural
A Terra tem mantido todos os gases nobres que estavam presentes em sua formação com exceção de hélio . Concentração de Krypton na atmosfera é de cerca de 1 ppm. Ele pode ser extraído de ar-líquido pela destilação fraccionada. A quantidade de crípton em espaço é incerto, como o montante é derivada da actividade meteórica e que a partir de ventos solares. As primeiras medições sugerem uma superabundância de krypton no espaço.
Aplicações


Várias linhas de emissão de Krypton fazer descargas de gás criptônio ionizado aparecem esbranquiçadas, que por sua vez torna as lâmpadas à base de krypton útil na fotografia como uma fonte de luz branca brilhante. Crípton é, assim, utilizado em alguns tipos de flashes fotográficos utilizados em alta velocidade de fotografia . Gás Krypton é também combinado com outros gases para fazer sinais luminosos que brilham com uma luz amarelo-esverdeada brilhante.
Krypton mistura com argônio como gás de enchimento de lâmpadas fluorescentes economizadoras de energia. Isto reduz o consumo de energia. Infelizmente isso também reduz a sua saída de luz e aumenta o seu custo. Krypton custa cerca de 100 vezes mais como árgon. Crípton (juntamente com xénon) também é utilizada para encher as lâmpadas incandescentes para reduzir a evaporação do filamento e permitem maior as temperaturas de funcionamento a serem utilizados para o filamento. A Brighter resultados claros que contém mais azul do que as lâmpadas convencionais.
Corrimento branco de Krypton é muitas vezes usado com bons resultados em tubos de descarga de gás coloridos, que são então simplesmente pintados ou manchados em outras maneiras de permitir que a cor desejada (por exemplo, " neon "sinais de propaganda do tipo em que as letras aparecem em diferentes cores são muitas vezes completamente baseada em crípton). Krypton também é capaz de muito maior densidade de potência de luz de néon na região espectral linha vermelha, e por esta razão, lasers vermelhos para de alta potência de laser-luz shows são muitas vezes lasers krypton com espelhos que seleccionam a linha espectral vermelho para a amplificação do laser e emissão, em vez de a variedade de hélio-neon mais familiar, que nunca poderia praticamente alcançar os multi-watt saídas de luz de laser vermelho necessários para esta aplicação.
Krypton tem um papel importante na produção e no uso do krypton laser de fluoreto. O laser tem sido importante para a comunidade de pesquisa em energia de fusão nuclear em experimentos de confinamento. O laser de feixe tem alta uniformidade, curta comprimento de onda, e a capacidade de modificar o tamanho do ponto de rastrear um sedimento implodir.
Em experimental de física de partículas , criptônio líquido é usado para construir quase homogênea eletromagnética calorímetros. Um exemplo notável é a do calorímetro Experiência NA48 no CERN contendo cerca de 27 toneladas de krypton líquido. Esta utilização é rara, uma vez que o líquido mais barato árgon é normalmente utilizado. A vantagem de krypton mais de argônio é um pequeno Molière raio de 4,7 cm, o que permite excelente resolução espacial e baixo grau de sobreposição. Os outros parâmetros relevantes para a aplicação da calorimetria são: comprimento de radiação X 0 = 4,7 centímetros, a densidade de 2,4 g / cm 3.
Os conjuntos spark gap fechados contidos em excitadores de ignição usados em alguns motores a jato mais velhos contêm uma quantidade muito pequena de Krypton-85 para obter níveis de ionização consistentes e operação uniforme.
Krypton-83 tem aplicação em ressonância magnética (MRI) para imagens vias aéreas. Em particular, pode ser usado para distinguir entre superfícies hidrófobas e hidrófilas que contêm uma via aérea.
Embora xénon tem potencial para uso em A tomografia computadorizada (TC) para avaliar a ventilação regional, as suas propriedades anestésicas limitar a sua fracção no gás de respiração a 35%. A utilização de uma mistura respiratória contendo 30% de xénon e crípton 30% é comparável em eficácia para TC a uma fracção do xénon de 40%, enquanto evita os efeitos indesejados de uma alta fracção de gás xenon.
Precauções
Crípton é considerado para ser um produto não tóxico asfixiante. Krypton tem um potência narcótico sete vezes maior do que o ar, de modo que a respiração de um gás contendo 50% de crípton e 50% de ar iria provocar narcose semelhante a respirar ar à pressão atmosférica quatro vezes. Isso seria comparável ao mergulho a uma profundidade de 30 m (100 pés) (ver narcose por nitrogênio) e, potencialmente, poderia afetar qualquer pessoa respirá-lo. No entanto, essa mistura que contêm apenas 10% de oxigénio e hipoxia seria uma maior preocupação.
