
Astatine
Sobre este escolas selecção Wikipedia
Esta seleção Wikipedia está offline disponível a partir de Crianças SOS, para distribuição no mundo em desenvolvimento. Você quer saber sobre o patrocínio? Veja www.sponsorachild.org.uk
| Astatine | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
85 At | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Aparência | ||||||||||||||||||||||||||||||||||
| desconhecida, mas provavelmente um preto sólido; possivelmente metálico na aparência | ||||||||||||||||||||||||||||||||||
| Propriedades gerais | ||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | astatine, At, 85 | |||||||||||||||||||||||||||||||||
| Pronúncia | / æ s t ə t Eu n / AS -tə-teen ou / æ s t ə t ɪ n / AS -tə-lata | |||||||||||||||||||||||||||||||||
| Categoria Metallic | halogéneo às vezes classificado como um metalóide (disputado) | |||||||||||||||||||||||||||||||||
| Grupo, período, bloco | (17) átomos de halogénio , 6, p | |||||||||||||||||||||||||||||||||
| Peso atômico padrão | (210) | |||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Xe ] 4f 14 5d 10 6s 2 6p 5 2, 8, 18, 32, 18, 7  | |||||||||||||||||||||||||||||||||
| História | ||||||||||||||||||||||||||||||||||
| Descoberta | Dale R. Corson, Kenneth Ross MacKenzie, Emilio Segrè (1940) | |||||||||||||||||||||||||||||||||
| Propriedades físicas | ||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||
| Ponto de fusão | 575 K , 302 ° C, 576 ° F | |||||||||||||||||||||||||||||||||
| Ponto de ebulição | 610 K, 337 ° C, 639 ° F | |||||||||||||||||||||||||||||||||
| Calor de vaporização | (At 2) 54,39 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| Pressão de vapor | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Propriedades atômicas | ||||||||||||||||||||||||||||||||||
| Estados de oxidação | -1, 1, 3, 5, 7 | |||||||||||||||||||||||||||||||||
| Eletronegatividade | 2,2 (escala de Pauling) | |||||||||||||||||||||||||||||||||
| Energias de ionização | 1º: 887,7 ± 38,59 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| O raio de covalência | 150 pm | |||||||||||||||||||||||||||||||||
| Van der Waals raio | 202 pm | |||||||||||||||||||||||||||||||||
| Miscelânea | ||||||||||||||||||||||||||||||||||
| Ordenamento magnético | sem dados | |||||||||||||||||||||||||||||||||
| Condutividade térmica | 1,7 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-68-8 | |||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | ||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de astato | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
Astatine é um radioativo elemento químico com o No símbolo químico e número atômico 85. Ocorre na Terra apenas como resultado do decaimento radioativo de alguns elementos mais pesados. Todos os seus isótopos são de curta duração; o mais estável é astatine-210, com uma meia-vida de 8,1 horas. Por conseguinte, muito menos se sabe sobre astatine que a maioria dos outros elementos. As propriedades observadas são consistentes com ele que é um análogo mais pesado de iodo ; muitas outras propriedades foram estimados com base nesta semelhança.
Astatine elementar nunca visto, porque uma massa suficientemente grande para ser visto (pelo olho humano nu) seria imediatamente vaporizado pelo calor gerado pela sua própria radioactividade. Astatine pode ser escuro, ou pode ter uma aparência metálica e seja um semicondutor, ou pode até ser um metal. É provável que tenha um ponto de fusão muito mais elevado do que o iodo, a par com os de bismuto e polônio. Quimicamente, astatine se comporta mais ou menos como um halogéneo , sendo esperado para formar astatides iónicos com metais alcalinos ou alcalino-terrosos, metais; sabe-se para formar compostos covalentes com não-metais, incluindo outros halogéneos. Ele, no entanto, também têm uma química catiônica notável que a distingue das halogênios mais leves. O segundo mais longevo isótopo de astatine, astatine-211, é o único que tem actualmente qualquer aplicação comercial, sendo empregadas na medicina para diagnosticar e tratar algumas doenças através da sua emissão de partículas alfa (hélio-4 núcleos). Apenas quantidades muito pequenas são utilizados, no entanto, devido à sua radioactividade intensa.
O elemento foi produzido pela primeira vez por Dale R. Corson, Kenneth Ross MacKenzie, e Emilio Segrè no University of California, Berkeley, em 1940. Eles nomearam o elemento "astato", um nome que vem da grande instabilidade da matéria sintetizado (a fonte palavra grega αστατος (astatos) significa "instável"). Três anos mais tarde, foi encontrado na natureza, embora seja o elemento menos abundante na crosta da Terra entre os não- elementos transurânicos, com um valor total estimado de menos de 28 gramas (uma onça) a qualquer momento. Seis isótopos astatine, com números de massa de 214-219, estão presentes na natureza como produtos de várias vias de decaimento dos elementos mais pesados, mas nem o isótopo mais estável de estatina (com um número de massa 210), nem astatine-211 (que é usado em medicina) é produzida naturalmente .
Características
Astatine é um elemento extremamente radioativo; todos os seus isótopos tem uma meia-vida de menos de 12 horas, de decair em bismuto , polônio , radônio , ou outros isótopos astatine. Entre os primeiros 101 elementos da tabela periódica, única frâncio é menos estável.
As propriedades a granel de astatine não são conhecidos com qualquer grande grau de certeza. A investigação é limitada pela sua meia-vida curta, o que evita a criação de quantidades pesáveis. Uma parte visível do astatine seria imediatamente e completamente vaporizado devido ao calor gerado pela sua radioactividade intensa. Astatine é geralmente classificado como um não-metal ou uma metalóide. No entanto, também foi sugerida a formação de metal para astatine-fase condensada.
Físico
A maior parte das propriedades físicas dos astatine foram estimados (por interpolação ou extrapolação), usando vários métodos teoricamente fundamentadas ou empiricamente derivados. Como exemplo, halogênios mais pesados são mais escuras que são halogênios de menor peso atômico - flúor é quase incolor, o cloro é verde-claro, o bromo é marrom, e iodo é cinza escuro / violeta. Astatine é por vezes descrito como sendo um sólido branco (assumindo que esta tendência resulta), ou como tendo uma aparência metálica (se é um metalóide ou um metal). Os fusão e pontos de ebulição também são esperados de astatine a seguir a tendência vista na série de halogéneo, aumentando com número atômico . Nesta base, os pontos de fusão e de ebulição estão estimados em 575 K (302 ° C; 575 ° C) e 610 K (337 ° C; 638 ° F), respectivamente. No entanto, algumas evidências experimentais sugerem astatine pode ter mais baixos de fusão e ebulição pontos do que aqueles sugeridos pela tendência de halogênio. Sublima astatine menos facilmente do que o iodo, com um menor pressão de vapor. Mesmo assim, a metade de uma dada quantidade de astatine irá vaporizar em uma hora se colocar em uma superfície de vidro limpo temperatura ambiente.
A estrutura cristalina de astatine sólido é desconhecido. A evidência para (ou contra) a existência de astatine diatômico (At 2) é escassa e inconclusiva. Algumas fontes afirmam que At 2 não existe, ou pelo menos nunca foi observada, enquanto outras fontes afirmam ou implicam a sua existência. Apesar desta controvérsia, muitas propriedades de astatine diatómico ter sido previsto.
Químico
Muitas propriedades químicas de astatine foram determinados utilizando estudos de traçadores em soluções astatine extremamente diluídas. Propriedades mais conhecidas - como a formação de ânion - estão em linha com outros halogênios. No entanto, astatine tem algumas características metálicas, bem como, tal como plaqueamento numa cátodo, coprecipitando com sulfuretos de metal em ácido clorídrico, e formando um catião em soluções ácidas fortes.
Astatine possui eletronegatividade de 2,2 na escala de Pauling revisto. Este é inferior ao de iodo (2,66) e o mesmo que o de hidrogénio. No entanto, em astatide hidrogênio (HAT) a carga negativa está previsto para ser no átomo de hidrogênio, o que implica que este composto deve antes ser referido como astatine hidreto. Neste contexto, é pertinente salientar que a eletronegatividade de astatine no Escala Allred-Rochow (1,9) é menor do que o de hidrogénio (2.2).
Compostos
Astatine é o menos reactivo dos halogéneos, ser menos reactivo do que o iodo; no entanto, vários compostos de astatine foram sintetizados em quantidades microscópicas e estudado tão intensivamente quanto possível antes de sua desintegração radioativa inevitável. As reacções envolvidas são normalmente testadas com soluções diluídas de astatine misturado com quantidades maiores de iodo. O iodo funciona como um veículo, assegurando que exista material suficiente para técnicas de laboratório (por exemplo, filtração e precipitação) a trabalhar.

A formação de um composto com hidrogénio astatine - geralmente referido como astatide hidrogênio - foi notada pelos pioneiros da astatine química. Como mencionado anteriormente, existem motivos para referindo-se este composto como astatine hidreto vez - astatine é facilmente oxidado, por acidificação (diluída) de ácido nítrico dá a A 0 ou em + formas, ea adição de prata (I), em seguida, precipita astatine, apenas parcialmente como prata (I) astatide (Agat) (ou não em todos). Iodo, em contraste, não é oxidada, e precipita facilmente como prata (I) iodeto.
Apenas alguns astatides de metal têm sido relatados, incluindo os de sódio, paládio, prata e chumbo. Algumas propriedades características de astatide prata, e os astatides alcalinos e alcalino-terrosos conhecidos e hipotéticos, foram estimados por extrapolação a partir de outros halogenetos de prata ou alcalino-terrosos ou alcalinos.
Astatine é conhecido por reagir com seus homólogos mais leves iodo, bromo , e cloro no estado de vapor; essas reações produzem diatómico interhalogénio compostos com fórmulas AtI, AtBr, e AtCl. Os dois primeiros compostos também podem ser produzidos em água - astatine reage com iodo / solução de iodeto para formar AtI, enquanto AtBr requer (além de astatine) um iodo / iodo monobrometo / solução de brometo. O excesso de iodetos ou brometos pode levar a AtBr -
2 e ATI -
Dois iões, ou em uma solução de cloreto, podem produzir espécies como AtCl -
2 ou AtBrCl - via reações de equilíbrio equilibrado com os cloretos. A oxidação do elemento com dicromato (em solução de ácido nítrico) mostrou que a adição de cloreto de virou o astatine numa molécula susceptível de ser AtCl ou AtOCl. Da mesma forma, AtOCl -
2 ou AtCl -
2 pode ser produzido. Em uma fonte de iões de plasma espectrómetro de massa , os iões semelhantes [AtI] +, [AtBr] + e [AtCl] + ter sido formado mediante a introdução de vapores mais leves de halogéneo em um hélio -filled célula contendo astatine, apoiar a existência de moléculas neutras estáveis no estado de iões de plasma. Sem fluoretos astatine foram descobertos até agora. A sua ausência foi especulativa atribuída à extrema reactividade de tais compostos, incluindo a reacção de um fluoreto inicialmente formada com as paredes do recipiente de vidro para formar um produto não volátil. Assim, embora a síntese de um fluoreto astatine é pensado para ser possível, pode exigir um solvente líquido fluoreto de halogéneo, tal como já foi usado para a caracterização de fluoretos de radão.
Com o oxigênio, não há evidência da existência da espécie ATO -, ATO -
2 e ATO + em solução aquosa, formada pela reacção de estatina com um oxidante tal como o bromo elementar ou (no último caso), através persulfato de sódio em uma solução de ácido perclórico. O ATO bem caracterizado -
3 anião pode ser obtido, por exemplo, a oxidação com hipoclorito de estatina de potássio em uma solução de hidróxido de potássio. A continuação da oxidação, tal como por difluoride xenon (em uma solução alcalina quente) ou periodato (em uma solução neutra ou alcalina), produz o ATO ion perastatate -
4; No entanto, isto só é estável em soluções neutras ou alcalinas. Astatine também é pensado para ser capaz de formar sais catiónicos, tais como com oxianiões iodato ou dicromato; isto é baseado na observação de que, em soluções ácidas, monovalente ou estados positivos intermédios de astatine co-precipitado com os sais insolúveis de catiões metálicos, tais como a prata (I), ou iodato de tálio (I) de dicromato.
Astatine podem formar ligações para o outro Calcogênios; estes incluem S 7 Na + e A (CSN) -
2 com enxofre , uma coordenação composto selenourea com selênio , e uma astatine- telúrio colóide com telúrio. Além disso, astatine é conhecido por se ligar ao azoto , de chumbo e de boro nas condições apropriadas.
Tetraastatide carbono (CAT 4) é conhecida. Astatine pode substituir um átomo de hidrogénio em benzeno para formar C 6 H 5 No; este pode ser oxidado para C 6 H 5 AtCl 2 por cloro. Ao tratar este composto com uma solução alcalina de hipoclorito, C 6 H 5 ATO 2 pode ser produzido.
História

Em 1869, quando Dmitri Mendeleev publicou sua tabela periódica , o espaço sob iodo estava vazio; depois de Niels Bohr estabeleceu a base física da classificação dos elementos químicos, sugeriu-se que o quinto halogênio pertencia lá. Antes de sua descoberta oficialmente reconhecido, ele foi chamado de "eka-iodo" (do sânscrito eka - "um") para insinua que era um espaço sob iodo (da mesma forma como EKA-silício, EKA-boro, e outros). Os cientistas tentaram encontrá-lo na natureza; dada a sua raridade, estas tentativas resultaram em uma série de falsas descobertas.
A primeira descoberta reivindicada de eka-iodo foi feita por Fred Allison e seus associados do Instituto Politécnico Alabama (agora Auburn University) em 1931. Os descobridores chamado elemento 85 "alabamine", e atribuiu-lhe o símbolo Ab, designações que foram usadas por alguns anos depois. Em 1934, no entanto, HG MacPherson de University of California, Berkeley refutada método de Allison ea validade de sua descoberta. Esta descoberta errada foi seguida por outra reivindicação em 1937, pelo químico Rajendralal De. Trabalhando em Dhaka , Índia britânica (hoje Bangladesh ), ele escolheu o nome "dakin" para o elemento 85, que ele alegou ter isolado como o série do tório equivalente de rádio F (polônio-210) no série do rádio. As propriedades relatadas para Dakin ele não correspondem às de astatine, e a verdadeira identidade de Dakin não é conhecido.

Em 1940, o químico suíço Walter Minder anunciou a descoberta de elemento 85 como o produto de decaimento beta Radium A (polônio-218), a escolha do nome "helvetium" (de Helvetia, "Suíça"). No entanto, Berta Karlik e Traude Bernert não tiveram sucesso em reproduzir seus experimentos, e, posteriormente, os resultados do Minder atribuídos à contaminação de seu fluxo de radão (radão-222 é o isótopo pai de polônio-218). Em 1942, Minder, em colaboração com o cientista Inglês Alice Leigh-Smith, anunciou a descoberta de um outro isótopo do elemento 85, que se presume ser o produto de tório A (polônio-216) decaimento beta. Eles nomeou esta substância "anglo-helvetium", mas Karlik e Bernert foram novamente incapazes de reproduzir estes resultados.
Em 1940, Dale R. Corson, Kenneth Ross MacKenzie, e Emilio Segrè finalmente isolou o elemento na Universidade da Califórnia, em Berkeley. Em vez de procurar o elemento na natureza, os cientistas criaram-lo bombardeando bismuto-209 com partículas alfa. O nome "astatine" vem do grego palavra αστατος (astatos, que significa "instável"), devido à sua propensão para decaimento radioactivo (mais tarde, todos os isótopos do elemento mostraram ser instável), em conjunto com o "-ine" terminando, encontrados nos nomes dos quatro halogéneos previamente descobertos. Três anos mais tarde, astatine foi encontrado como um produto de ocorrência natural cadeias de desintegração por Karlik e Bernert. Desde então, astatine foi determinada como sendo em três das quatro cadeias de decaimento natural.
Isótopos
Existem 32 isótopos conhecidos de astatine, com massas atômicas (números de massa) de 191 e 193-223. Sem isótopo astatine estável ou até mesmo de longa duração é conhecida, e é esperado nenhum tal isótopo de existir.
Características de decaimento alfa de isótopos amostra astatine Massa
númeroMassa
excessoMassa
excesso de
filhaMédia
energia de
alfa
decadênciaMeia-vida Probabilidade
de alfa
decadênciaAlfa
meia-vida207 -13,243 MeV -19,116 MeV 5,873 MeV 1.80 h 8,6% 20.9 h 208 -12,491 MeV -18,243 MeV 5,752 MeV 1.63 h 0,55% 12,3 d 209 -12,880 MeV -18,638 MeV 5,758 MeV 5.41 h 4,1% 5.5 d 210 -11,972 MeV -17,604 MeV 5,632 MeV 8.1 h 0,175% 193 d 211 -11,647 MeV -17,630 MeV 5,983 MeV 7.21 h 41,8% 17.2 h 212 -8,621 MeV -16,436 MeV 7,825 MeV 0.31 s ≈100% 0.31 s 213 -6,579 MeV -15,834 MeV 9,255 MeV 125 ns 100% 125 ns 214 -3,380 MeV -12,366 MeV 8,986 MeV 558 ns 100% 558 ns 219 10,397 MeV 4,073 MeV 6,324 MeV 56 s 97% 58 s 220 14,350 MeV 8,298 MeV 6,052 MeV 3.71 min 8% 46,4 min 221 16,810 MeV 11,244 MeV 5,566 MeV 2,3 min experimentalmente
alfa estável∞
Astatine tem 23 isómeros nucleares, que são núcleos com um ou mais núcleons ( prótons ou nêutrons ) em um estado animado. Um isómero nuclear pode também ser chamado uma " meta-estado ", ou seja, o sistema tem mais energia interna do que o " Estado chão "(o estado de menor energia possível interno), tornando o anterior susceptíveis de deteriorar no último. Pode haver mais do que um isómero de cada isótopo. A mais estável desses isómeros nucleares é astatine-202m1, que tem um meia-vida de cerca de 3 minutos, mais longo do que as de todos os estados fundamentais, excepto para aqueles isótopos de 203-211 e 220. A menos estável é uma astatine-214m1; a sua semi-vida de 265 nanossegundos é mais curto do que os de todos os estados fundamentais, exceto o de astatine-213.
Astatine do alfa energias decaimento seguir a mesma tendência como para outros elementos pesados. Mais leves isótopos astatine tem bastante altas energias de decaimento alfa, que se tornam mais baixo como os núcleos se tornam mais pesado. Astatine-211, no entanto, tem uma energia significativamente maior do que o isótopo anterior, porque tem um núcleo com neutrões 126, e 126 é um número mágico que corresponde a uma concha cheia de nêutrons. Apesar de ter uma meia-vida do isótopo semelhante ao anterior (8,1 horas para astatine-210 e 7,2 horas para a astatina-211), a probabilidade de deterioração alfa é muito mais elevada para o último: 41,81% contra apenas 0,18%. Os dois seguintes isótopos libertar ainda mais energia, com astatine-213 lançando a maior quantidade de energia de todos os isótopos astatine. Por este motivo, é o isótopo de vida mais curta astatine. Mesmo que mais pesados isótopos astatine liberar menos energia, não existe vida longa isótopo astatine, devido ao papel cada vez maior de decaimento beta (emissão de electrões). Este modo de decaimento é especialmente importante para astatine; em 1950, foi postulado que o elemento não tem beta-isótopos estáveis (isto é, aqueles que não o fazem decaimento beta em tudo). Modos de decaimento beta foram encontrados para todos os isótopos astatine exceto astatine-213, astatine-214, astatine-215, e astatine-216m. Isótopos mais leves Astatine-210 e exposição beta mais decadência ( Positron Emission), isótopos mais pesados astatine-216 e exposição beta (menos) decadência, e astatine-212 decai via ambos os modos, enquanto astatine-211 sofre captura de elétrons em vez disso.
O isótopo mais estável é astatine-210, que tem uma meia-vida de 8,1 horas. Modo de decaimento deste isótopo é mais beta decadência à relativamente longa vida (em comparação com isótopos astatine) alfa emissor polônio-210. No total, apenas cinco isótopos tem uma meia-vida superior a uma hora (aqueles com números de massa entre 207 e 211). O isótopo estável estado fundamental é menos astatine-213, com meia-vida de 125 nanossegundos. Ele alfa decai para o extremamente longa vida (na prática, estável) bismuto-209.
Ocorrência natural
Astatine é o mais raro elemento de ocorrência natural que não é um transurânico elemento, com a quantidade total na crosta terrestre estimada em menos do que 28 gramas (uma onça) em qualquer dado momento. Qualquer astatine que esteve presente na formação da Terra há muito tempo já deteriorado, e as quantidades de astatine minuto existentes atualmente têm formado pela decomposição de elementos mais pesados. Embora tenha sido previamente pensado para ser o elemento mais raro que ocorre na Terra, astatine perdeu esse estatuto a berquélio , os átomos dos quais podem ser produzidos por reações de captura de nêutrons e decaimento beta em muito altamente concentrados de urânio depósitos -bearing.
Seis isótopos astatine ocorrem naturalmente (astatine-214 para astatine-219). Por causa de suas curtas meias-vidas , eles são encontrados apenas em quantidades vestigiais. Não há dados indicando que astatine ocorre em estrelas.
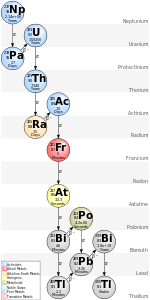
Quatro desses isótopos (astatine-215, astatine-217, astatine-218, e astatine-219) encontram-se, devido à sua produção em grande naturais cadeias de desintegração. Frâncio-223, o isótopo pai de astatine-219, alfa decai com uma probabilidade de apenas 0,006%, tornando este isótopo astatine extremamente raro, mesmo em comparação com os outros isótopos astatine; este é, apesar da sua meia-vida sendo o mais longo dos isótopos astatine naturais (56 segundos). Astatine-219 decai para polônio-215, que se beta decai para astatine-215 com uma probabilidade ainda menor de 0,00023%. A totalidade do Norte e América do Sul combinado, considerado até uma profundidade de 16 km (10 milhas), contêm apenas cerca de um trilhão astatine-215 átomos em um determinado momento. Astatine-218 é encontrado na natureza como resultado de polônio-218 decaimento beta; como com francium-223 eo polônio-215, um isótopo de decadência astatine não é o principal modo de decaimento. No entanto, o isótopo astatine-217 tem uma cadeia linear levando diretamente para astatine; seu isótopo pai (francium-221) decai exclusivamente a esta nuclide. Dado que o seu pais, avós, e assim por diante cada decaimento exclusivamente a apenas um nuclídeo, este apresenta apenas uma maneira possível para o nuclido começando no neptunium série ( neptunium -237) à decadência - via eventual produção de astato-217.
Os isótopos com números de massa 214 através de 216 são encontrados como resultado de decaimento alfa triplo do presente naturalmente protactinium isótopos protactinium-226, protactinium-227, e protactinium-228. No entanto, estes isótopos são extremamente raros, tanto assim que muitas vezes não são citados como isótopos astatine natural.
Síntese
Formação
Possíveis reações após bombardeando bismuto-209 com partículas alfa Reação Energia de partículas alfa 209
83 Bi + 4
2 Ele → 211
Em 85 + 2 1
026 MeV 209
83 Bi + 4
2 Ele → 210
Em 85 + 3 1
040 MeV 209
83 Bi + 4
2 Ele → 209
Em 85 + 4 1
060 MeV
Astatine foi produzido pela primeira vez bombardeando bismuto-209 com partículas alfa energéticas, e este ainda é a principal via utilizada para criar a relativamente longa vida isótopos astatine-209 através astatine-211. Astatine só é produzido em quantidades microscópicas, com técnicas modernas que permitem execuções de produção de 2 tera becquerel (cerca de 25 microgramas ).
O isótopo mais importante é astatine-211, o único a ter actualmente uma utilização comercial. Para produzir o alvo de bismuto, o metal é atomizados para um, o cobre, o ouro ou a superfície de alumínio a 50 a 100 miligramas por centímetro quadrado. A camada de bismuto, ou alternativamente óxido de bismuto, é forçosamente fundido com uma placa de cobre. O alvo é mantida sob um azoto quimicamente neutro atmosfera, e é arrefecida com água para evitar a prematura vaporização astatine. Em um acelerador de partículas, tal como um ciclotrão, partículas alfa (hélio-4 núcleos) são colidiu com o bismuto. Mesmo que haja apenas um isótopo de bismuto usado (bismuto-209), a reação pode ocorrer de três formas possíveis, produzindo astatine-209, astatine-210, ou astatine-211. A fim de eliminar os nuclídeos indesejados, o máximo de energia do acelerador de partículas é definida como qualquer valor (como 30 MeV) acima que para a reacção de produção astatine-211 (para produzir o isótopo desejado) e a seguir a uma produção de astatine-210 ( para evitar a produção de outros isótopos astatine).
Separação
Uma vez que o elemento é o produto principal da síntese, após a sua formação tem de ser apenas separado do alvo e vestígios de outros radioisótopos. O alvo contendo astatine é aquecida a 270 ° C (520 ° F) para vaporizar distância vestígios voláteis de radioisótopos, após o que a temperatura é aumentada para 800 ° C (1450 ° F). Embora 80% dos astatine pode vaporizar-se a esta temperatura, começa a vaporizar bismuto bem. Vaporização da astatine não ocorre a uma velocidade adequada, a temperaturas abaixo de 600 ° C (1100 ° F), mas, a temperaturas acima de 800 ° C (1450 ° F), a volatilidade do astatine a partir de uma superfície de bismuto aumenta significativamente. O vapor condensado ( destilado ) é recolhido sobre uma superfície de platina arrefecido a água, que é posteriormente transferida para um L-como quartzo navio. O vaso do recipiente de quartzo é aquecida a 130 ° C (270 ° F) a remoção de quaisquer vestígios de impurezas (tipicamente polônio) e, em seguida, a 500 ° C (930 ° F) para remover astatine, que é recolhido numa dedo frio. O elemento purificado é então lavado para fora da haste de refrigeração com uma solução fraca de ácido nítrico. Usando esta técnica, os rendimentos de astatine de até 30% podem ser alcançados.
Usos e precauções
Vários 211At contendo moléculas e as suas utilizações Agente Aplicações [211] No colóides astatine-telúrio Tumores compartimentados 6- [211At] astato-2-metil-1,4-difosfato naphtaquinol Adenocarcinomas 211 azul de metileno a-marcado Melanomas Meta [211 At] astatobenzyl guanidina Os tumores neuroendócrinos 5- [211At] astato-2'-desoxiuridina Vário 211 conjugados de biotina At-rotulados Vários pr�marca�o 211 octreotida Na marcado Receptor de somatostatina 211 mAbs e fragmentos marcados No Vário 211 bisfosfonatos At-rotulados As metástases ósseas
O astatine-211 recém-formado é importante na medicina nuclear. Uma vez produzido, astatine deve ser utilizado rapidamente, como ele decai com uma meia-vida de 7,2 horas; esta é, no entanto, o tempo suficiente para permitir a estratégias de rotulagem multi-passo. Astatine-211 pode ser utilizado para a radioterapia direccionada de partículas alfa, uma vez que ele decai quer através de emissão de uma partícula alfa (de bismuto-207), ou através captura de elétrons (para uma nuclide extremamente curta duração de polônio-211, que se passa por mais decaimento alfa).
De um modo semelhante ao iodo, astatine é preferencialmente concentrada no glândula tiróide, embora em menor grau. No entanto, tende a concentrar-se na fígado sob a forma de um radiocolóide se for libertada para a circulação sistémica. A diferença entre medicinal diretor astatine-211 e iodo-131 (um isótopo radioactivo de iodo, também utilizada em medicina) é que astatine não emite partículas beta de alta energia (electrões), assim como iodo-131. Partículas beta têm consideravelmente maior poder de penetração através dos tecidos do que as partículas alfa muito mais pesados. Enquanto uma média alfa energia da partícula liberado pelo decaimento do astatine-211 pode viajar até 70 mm através dos tecidos circundantes, uma partícula beta médio de energia emitida pelo iodo-131 pode viajar quase 30 vezes mais longe, a cerca de 2 mm. Assim, usando astatine-211 em vez de iodo-131 permite que a tiróide a ser doseada de forma adequada, enquanto que o vizinho glândula paratireóide é poupada. A meia-vida curta e limitada do seu poder de penetração da radiação através dos tecidos torna astatine geralmente preferível para o iodo-131, quando utilizado em diagnóstico, bem.
Experiências em ratos e macacos, no entanto, sugerem que astatine provoca danos muito maiores para a glândula tiróide do que a iodo-131, com injecção repetida do nuclídeo resultando em necrose e células displasia dentro da glândula. Estas experiências também sugerem que astatine poderia causar danos ao tiróide de qualquer organismo. As primeiras pesquisas sugerem que a injeção de quantidades letais de astatine causado alterações morfológicas no tecido mamário (embora não em outros tecidos); no entanto, esta conclusão permanece atualmente controversa.
