
Samário
Sobre este escolas selecção Wikipedia
Crianças SOS tentou tornar o conteúdo mais acessível Wikipedia por esta selecção escolas. Clique aqui para mais informações sobre Crianças SOS.
| Samário | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
62 Sm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
branco prateado  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | samário, Sm, 62 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / s ə m ɛər Eu ə m / sə- MAIR -ee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria elemento | lantanídeos | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | n / D, 6, f | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | 150,36 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Xe ] 6s 2 4f 6 2, 8, 18, 24, 8, 2  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| História | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descoberta | Lecoq de Boisbaudran (1879) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primeiro isolamento | Lecoq de Boisbaudran (1879) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 7,52 g cm -3 · | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidade no pf | 7,16 g cm -3 · | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 1345 K , 1072 ° C, 1962 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 2067 K, 1794 ° C, 3261 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusão | 8,62 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporização | 165 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 29,54 J · · mol -1 K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 4, 3, 2, 1 (Levemente óxido de base) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 1,17 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização | 1º: 544,5 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Segunda: 1070 kJ mol -1 · | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3: 2260 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atômico | 180 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 198 ± 20:00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | rhombohedral 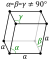 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | paramagnético | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistividade elétrica | ( RT) (α, poli) 0,940 μΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 13,3 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Expansão térmica | ( RT) (α, poli) 12.7 uM / (mK) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C) 2.130 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O módulo de Young | (Forma α) 49,7 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de cisalhamento | (Forma α) 19,5 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa de módulo | (Forma α) 37,8 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rácio de Poisson | (Forma α) 0,274 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Vickers | 412 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 441 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-19-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de samário | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Samário é um elemento químico com o símbolo Sm e número atômico 62. É um prateado moderadamente dura de metal que se oxida facilmente no ar. Ser um membro típico da lanthanide série, samário geralmente assume o estado de oxidação +3. Os compostos de samário (II) também são conhecidos, mais notavelmente a monóxido de SMO, monochalcogenides SMS, SMSE e SMTE, bem como samário (II) de iodeto. O último composto é um comum agente de redução de síntese química. Samário não tem nenhum papel biológico significativo e é apenas ligeiramente tóxico.
Samário foi descoberto em 1879 pelo químico francês Paul Émile Lecoq de Boisbaudran e nomeado após o mineral samarskita partir do qual foi isolado. O mineral em si foi anteriormente nomeado após um oficial mina russa, coronel Vasili Samarsky-Bykhovets, que assim se tornou a primeira pessoa a ter um elemento químico que leva seu nome, ainda que indirectamente. Embora classificado como um terra-rara, samário é o elemento mais abundante 40 na crosta da Terra e é mais comum do que metais como estanho . Samário ocorre com concentração de até 2,8% em diversos minerais, incluindo cerite, gadolinite, samarskite, monazita e bastnäsite, os dois últimos sendo as fontes comerciais mais comuns de elemento. Estes minerais são encontrados principalmente na China , o Estados Unidos , Brasil , Índia , Sri Lanka e Austrália ; A China é de longe o líder mundial em mineração de samário e produção.
A principal aplicação comercial de samário é em ímãs samário cobalto, que têm magnetização permanente apenas a segunda ímãs de neodímio; no entanto, os compostos de samário pode resistir a temperaturas significativamente mais elevadas, acima de 700 ° C, sem perder as suas propriedades magnéticas. A radioativo de isótopos samário-153 é o principal componente da droga samário (153 Sm) lexidronam (Quadramet), que mata células cancerosas no tratamento de câncer de pulmão , cancro da próstata, câncer de mama e osteossarcoma. Outro isótopo, samário-149, é uma forte neutrões absorvente e, portanto, é adicionado à hastes de controle reatores nucleares. É também formado como um produto de decomposição, durante o funcionamento do reactor e é um dos factores importantes considerados na concepção do reactor e operação. Outras aplicações incluem o samário de catálise de reacções químicas , datação radioativa e um Laser de raios-X.
Propriedades físicas
Samário é um metal de terras raras possuindo a dureza e densidade semelhantes às de zinco . Com o ponto de ebulição 1794 ° C, samário é o terceiro dos lantanídeos mais volátil depois de itérbio e európio ; esta propriedade facilita a separação de samário do minério mineral. Em condições ambientes, samário assume normalmente uma estrutura triangular (forma α). Após aquecimento a 731 ° C, a sua simetria do cristal muda para hexagonal cheio de perto (hcp), no entanto, a temperatura de transição depende da pureza do metal. Aquecimento adicional a 922 ° C transforma o metal em um cúbico (BCC) fase de corpo centrado. O aquecimento a 300 ° C, combinada com a compressão para 40 kbar resultados em uma estrutura cheia de perto duas vezes hexagonal (DHCP). Aplicando uma pressão mais elevada da ordem de centenas ou milhares de kilobars induz uma série de transformações de fase, em particular com um fase tetragonal aparecendo em cerca de 900 kbar. Num estudo, a fase de DHCP pode ser produzido sem compressão, utilizando um regime de não equilíbrio de recozimento com uma mudança rápida de temperatura entre cerca de 400 e 700 ° C, o que confirma o carácter desta fase transitória de samário. Além disso, as películas finas de samário obtidos por deposição de vapor pode conter as fases HCP ou DHCP em condições ambiente.
Samário (e sua sesquióxido) são paramagnético à temperatura ambiente. Os momentos magnéticos eficazes correspondentes, inferiores a 2 μ B, são o terceiro mais baixo entre os lantanídeos (e seus óxidos) após lantânio e lutécio. O metal transforma a um estado antiferromagnetic após arrefecimento até 14,8 átomos K. Pessoa samário pode ser isolado encapsulando-os em moléculas de fulereno. Eles também podem ser dopado entre as moléculas de C 60 no fulereno sólida, tornando- supercondutores em temperaturas abaixo de 8 K. Samário doping de supercondutores baseados em ferro - o mais recente classe de supercondutores de alta temperatura - permite aumentar a sua temperatura de transição a 56 K, que é o valor mais alto alcançado até agora nesta série.
Propriedades químicas
Samário recentemente preparado tem um brilho prateado. No ar, oxida-lo lentamente à temperatura ambiente e inflama-se espontaneamente a 150 ° C . Mesmo quando armazenado sob óleo mineral, samário, gradualmente, se oxida e se desenvolve de um pó amarelo-acinzentado do óxidos de hidróxido de mistura na superfície. A aparência metálica de uma amostra podem ser preservados por meio de selagem que sob um gás inerte tal como árgon .
Samário é bastante electropositive e reage lentamente com água fria e muito rapidamente com água quente para formar hidróxido de samário:
- 2 Sm (s) + 6 H2O (l) → 2 Sm (OH) 3 (aq) + 3H 2 (g)
Samário se dissolve facilmente em diluída de ácido sulfúrico para formar soluções contendo o amarelo pálido (III) iões verdes Sm, que existem como [SM (OH 2) 9] 3+ complexos:
- 2 Sm (s) + 3 H 2 SO 4 (aq) → 2 Sm 3+ (aq) + SO 3 2-
4 (aq) + 3H 2 (g)
Samário é um dos poucos lantanídeos que apresentam o estado de oxidação +2. Os íons Sm 2+ estão em soluções de vermelho-sangue.
Compostos
| Fórmula | cor | simetria | grupo espacial | Não | Símbolo Pearson | A (pm) | b (pm) | c (h) | Z | densidade, g / cm 3 |
|---|---|---|---|---|---|---|---|---|---|---|
| Sm | argênteo | trigonal | R3 m | 166 | HR9 | 362,9 | 362,9 | 2.621,3 | 9 | 7,52 |
| Sm | argênteo | hexagonal | P6 3 / mmc | 194 | HP4 | 362 | 362 | 1168 | 4 | 7,54 |
| Sm | argênteo | tetragonal | I4 / mmm | 139 | Ti2 | 240.2 | 240.2 | 423,1 | 2 | 20.46 |
| SMO | dourado | cúbico | Fm 3 m | 225 | CF8 | 494,3 | 494,3 | 494,3 | 4 | 9.15 |
| Sm 2 O 3 | trigonal | P 3 M1 | 164 | hP5 | 377.8 | 377.8 | 594 | 1 | 7,89 | |
| Sm 2 O 3 | monoclinic | C2 / m | 12 | MS30 | 1418 | 362.4 | 885,5 | 6 | 7,76 | |
| Sm 2 O 3 | cúbico | Ia 3 | 206 | cI80 | 1093 | 1093 | 1093 | 16 | 7.1 | |
| SMH 2 | cúbico | Fm 3 m | 225 | CF12 | 537,73 | 537,73 | 537,73 | 4 | 6.51 | |
| SMH 3 | hexagonal | P 3 c1 | 165 | hP24 | 377.1 | 377.1 | 667,2 | 6 | ||
| Sm 2 B 5 | cinza | monoclinic | P2 1 / c | 14 | MP28 | 717,9 | 718 | 720,5 | 4 | 6.49 |
| SMB 2 | hexagonal | P6 / mmm | 191 | HP3 | 331 | 331 | 401,9 | 1 | 7,49 | |
| SMB 4 | tetragonal | P4 / MBM | 127 | TP20 | 717,9 | 717,9 | 406,7 | 4 | 6.14 | |
| SMB 6 | cúbico | Pm 3 m | 221 | cp7 | 413,4 | 413,4 | 413,4 | 1 | 5.06 | |
| SMB 66 | cúbico | Fm 3 c | 226 | cF1936 | 2.348,7 | 2.348,7 | 2.348,7 | 24 | 2.66 | |
| Sm 2 C 3 | cúbico | I 4 3d | 220 | cI40 | 839,89 | 839,89 | 839,89 | 8 | 7.55 | |
| SmC 2 | tetragonal | I4 / mmm | 139 | tI6 | 377 | 377 | 633.1 | 2 | 6.44 | |
| FSm 2 | roxo | cúbico | Fm 3 m | 225 | CF12 | 587,1 | 587,1 | 587,1 | 4 | 6.18 |
| FSm 3 | branco | orthorhombic | PNMA | 62 | OP16 | 667,22 | 705,85 | 440,43 | 4 | 6.64 |
| SmCl 2 | marrom | orthorhombic | PNMA | 62 | OP12 | 756,28 | 450,77 | 901,09 | 4 | 4,79 |
| SmCl 3 | amarelo | hexagonal | P6 3 / m | 176 | HP8 | 737,33 | 737,33 | 416,84 | 2 | 4.35 |
| SMBR 2 | marrom | orthorhombic | PNMA | 62 | OP12 | 797,7 | 475,4 | 950.6 | 4 | 5,72 |
| SMBR 3 | amarelo | orthorhombic | Cmcm | 63 | oS16 | 404 | 1265 | 908 | 2 | 5.58 |
| Sml2 | verde | monoclinic | P2 1 / c | 14 | MP12 | |||||
| SMI 3 | laranja | trigonal | R3 | 63 | hR24 | 749 | 749 | 2080 | 6 | 5.24 |
| SMN | cúbico | Fm 3 m | 225 | CF8 | 357 | 357 | 357 | 4 | 8,48 | |
| PMS | cúbico | Fm 3 m | 225 | CF8 | 576 | 576 | 576 | 4 | 6.3 | |
| SMAS | cúbico | Fm 3 m | 225 | CF8 | 591,5 | 591,5 | 591,5 | 4 | 7,23 |
Óxidos
O óxido de samário mais estável é a sesquióxido Sm 2 O 3. Tal como muitos outros compostos samário, ela existe em várias fases cristalinas. A forma trigonal é obtido por arrefecimento lento a partir da massa fundida. O ponto de Sm 2 O 3 de fusão é bastante elevada (2345 ° C) e, por conseguinte, de fusão é normalmente conseguido não por aquecimento directo, mas com aquecimento por indução, através de uma bobina de radiofreqüência. O Sm 2 O 3 cristais de simetria monoclínica podem ser cultivadas pelo método de fusão de chama ( Verneuil processo) a partir do pó Sm 2 O 3, que produz lingotes cilíndricos até vários centímetros de comprimento e cerca de um centímetro de diâmetro. Os lingotes são transparentes quando puro e livre de defeitos e são de cor laranja contrário. Aquecendo o trigonal metaestável Sm 2 O 3-1900 ° C converte-o para a fase monoclínica mais estável. Cúbica Sm 2 O 3 também foi descrito.
Samário é um dos poucos lantanídeos que formam um monóxido de carbono, SMO. Este composto dourado-amarelo brilhante foi obtido por redução de Sm 2 O 3 com o samário de metal, a temperatura elevada (1000 ° C) e pressão acima de 50 kbar; redução da pressão resultou numa reacção incompleta. SMO tem a estrutura de treliça de sal-gema cúbico.
Chalcogenides
Samário forma trivalente sulfureto, seleneto e Telluride. Bivalentes chalcogenides SMS, SMSE e SMTE com estrutura de cristal de sal-gema cúbica também são conhecidos. Eles são notáveis por conversão de semicondutor de estado metálico à temperatura ambiente após a aplicação da pressão. Considerando que a passagem é contínuo e ocorre em cerca de 20-30 kbar em SMSE e SMTE, é abrupta no SMS e requer apenas 6,5 kbar. Este efeito resulta em espetacular mudança de cor no SMS do preto ao amarelo dourado quando seus cristais de filmes estão riscados ou polido. A transição não altera a simetria da estrutura, mas há um decréscimo acentuado (~ 15%) no volume do cristal. Ele mostra histerese, que é quando a pressão é liberada, SMS retorna ao estado semicondutor em muito menor pressão de cerca de 0,4 kbar.
Halides
Samário de metal reage com todos os átomos de halogénio X = F, Cl, Br ou I, tri-halogenetos de Forma:
- 2 Sm (s) + 3 X 2 (g) → SMX 2 3 (s)
Sua nova redução com samário, lítio ou sódio metais a temperaturas elevadas (cerca de 700-900 ° C) produz dialogenetos. O diiodeto também pode ser preparado por aquecimento de SMI 3, ou por reacção do metal com 1,2-diiodoetano em anidro tetra-hidrofurano, à temperatura ambiente:
- Sm (s) + ICH 2 CH 2 I → SMI 2 + 2 CH = CH 2.
Além de di-halogenetos, a redução também produz numerosas halogenetos samário não-estequiométrico com uma estrutura cristalina bem definida, tais como Sm 3 F 7, Sm 14 F 33, Sm 27 M 64, Sm 11 Br 24, Sm 5 Br 11 e Sm 6 Br 13.
Conforme reflectido na tabela acima, halogenetos de samário alterar as suas estruturas cristalinas quando um tipo de átomos de halogeneto é substituído por outro, o que é um comportamento raro que a maioria dos elementos actinídeos (por exemplo). Muitos halogenetos tem duas grandes fases de cristal para uma composição, sendo um deles significativamente mais estável e um outro metastable ser. A última é formada por compressão ou de aquecimento, seguido de paragem às condições ambientais. Por exemplo, comprimindo o diiodeto samário monoclinic habitual e liberando a pressão provoca a 2 do tipo estrutura ortorrômbica PbCl (densidade 5,90 g / cm 3), e os resultados do tratamento semelhantes em uma nova fase de samário triiodide (densidade de 5,97 g / cm 3) .
Boretos
Sinterização de pós de óxido de samário e boro, em vácuo, produz um pó contendo várias fases de boreto samário, e a sua proporção em volume pode ser controlado através da proporção de mistura. O pó pode ser convertido em cristais grandes de um certo boreto utilizando samário fusão ou arco técnicas de fusão de zona, contando com a diferente temperatura de fusão / cristalização de SMB 6 (2580 ° C), SMB 4 (cerca de 2300 ° C) e 66 SMB (2150 ° C). Todos estes materiais são frágeis, sólidos duros, escuro-cinza com a dureza aumenta com o teor de boro. Samário diboreto é muito volátil para ser produzido com estes métodos e requer alta pressão (cerca de 65 kbar) e baixas temperaturas entre 1140 e 1240 ° C, para estabilizar o seu crescimento. Aumentar os resultados de temperatura nas formações preferenciais de 6 SMB.
Samário hexaboreto
Samário hexaboreto é um composto típico intermédia valência onde samário está presente tanto como Sm 2+ e Sm 3+, na proporção de 3: 7. Ela pertence a uma classe de Kondo isoladores, que é a temperaturas elevadas (acima de 50 K), as suas propriedades são típicas de um metal Kondo, com condutividade eléctrica metálico caracterizado por uma forte dispersão de electrões, enquanto a baixas temperaturas, comporta-se como um isolador não magnético com uma estreita gap de cerca de 4-14 meV. A transição metal-isolante induzida pelo arrefecimento no SMB 6 é acompanhada por um forte aumento no condutividade térmica, atingindo um máximo de cerca de 15 K. A razão para este aumento é que os electrões não contribuem eles próprios para a condutividade térmica a temperaturas baixas, o que é dominado pelos fônons, mas a diminuição da concentração de elétrons reduziu a taxa de elétron-fônon de espalhamento.
Nova pesquisa parece mostrar que ele pode ser um Isolante topológico.
Outros compostos inorgânicos

Samário carbonetos são preparadas por fusão de uma mistura de grafite e metais em uma atmosfera inerte. Após a síntese, que são instáveis ao ar e são estudados também sob atmosfera inerte. Samário monophosphide PMS é um semicondutor com a banda proibida de 1,10 eV, o mesmo que no silício , e elevada condutividade eléctrica do tipo n . Pode ser preparado por recozimento a 1100 ° C numa ampola de quartzo evacuados contendo pós misturados de fósforo e samário. O fósforo é altamente volátil a temperaturas elevadas e podem explodir, assim, a taxa de aquecimento tem que ser mantida bem abaixo de 1 ° C / min. Procedimento semelhante é adoptado para o monarsenide smas, mas a temperatura de síntese é mais elevado a 1800 ° C.
Um grande número de compostos binários cristalinas são conhecidas por samário e um do grupo de 4, 5 ou 6 elemento X, onde X é Si, Ge, Sn, Pb, Sb ou Te, e as ligas metálicas de forma samário outro grande grupo. Eles são todos preparados por recozimento de pós misturados os elementos correspondentes. Muitos dos compostos resultantes são não-estequiométrica e têm composições nominais SM a b X, em que o b / a proporção varia entre 0,5 e 3.
Os compostos organometálicos
Samário forma uma ciclopentadieneto Sm (C 5 H 5) 3 e suas chloroderivatives Sm (C 5 H 5) 2 Cl e Sm (C 5 H 5) Cl 2. Eles são preparados pela reacção de tricloreto de samário com NaC 5 H 5 em tetra-hidrofurano. Contrariamente à maioria dos outros cyclopentadienides de lantanídeos, em Sm (C 5 H 5) 3 some C 5 H 5 anéis ponte entre si por formação de anel vértices η 1 ou bordas η 2 em direção a outro átomo de samário vizinho, criando cadeias poliméricas. O Sm chloroderivative (5 C 5 H) Cl 2 tem uma estrutura de dímero, o qual é expressa de forma mais exacta (η 5 -C 5 H 5) 2 Sm (μ-Cl) 2 (η 5 -C 5 H 5) 2. Ali, as pontes de cloro pode ser substituído, por exemplo, por átomos de hidrogénio, de iodo ou de azoto ou por grupos CN.
A (C 5 H 5) - ião em cyclopentadienides samário pode ser substituído pelo indenide (C 9 H 7) - ou cyclooctatetraenide (C 8 H 8) 2- anel, resultando em SM (C 9 H 7) 3 ou KSM (η -C 8 8 8 H) 2. O último composto tem uma estrutura semelhante à de uranocene. Há também uma ciclopentadieneto de samário divalente, Sm (C 5 H 5) 2 - um sólido que sublima a cerca de 85 ° C. Contra ferroceno, os C 5 H 5 anéis em Sm (C 5 H 5) 2 não são paralelos, mas são inclinadas de 40 °.
Alquilos e arilos de samário são obtidos através de um reacção de metátese em tetra-hidrofurano ou éter :
- SmCl 3 + 3 LiR → SmR 3 + 3 LiCl
- Sm (OR) 3 + 3 Lich (SiMe3) 2 → Sm {CH (SiMe3) 2} 3 + 3 LiOR
Aqui R é um grupo hidrocarboneto e Me significa metilo.
Isótopos
De ocorrência natural tem um samário radioactividade de 128 Bq / g. É composto por quatro estáveis isótopos : 144 Sm, 150 Sm, 152 e 154 Sm Sm, e três extremamente longa duração radioisótopos, 147 Sm (meia-vida t½ = 1,06 × 10 11 anos), 148 Sm (7 × 10 15 anos) e 149 Sm (> 2 × 10 15 anos), com 152 Sm sendo o mais abundante ( abundância natural de 26,75%). 149 Sm é listado por várias fontes ou de isótopos como estável ou radioativo.
Os isótopos de longa duração, 146 Sm, 147 Sm, e 148 Sm, principalmente decaimento por emissão de partículas alfa para isótopos de neodímio . Mais leves isótopos instáveis de samário principalmente decadência por a captura eletrônica de isótopos de promécio , enquanto os mais pesados convertem através decaimento beta de isótopos de európio .
O alfa-decaimento do 147 Sm para 143 Nd com uma meia-vida de 1,06 × 10 11 anos para servir samário-neodímio namoro
As meias-vidas de 151 Sm e 145 Sm são 90 anos e 340 dias, respectivamente. Todos os restantes radioisótopos tem uma meia-vida de menos de 2 dias, e a maioria delas têm semi-vidas que são menos de 48 segundos. Samário também tem cinco isómeros nucleares com a 141m ser mais estável Sm ( meia-vida de 22,6 minutos), 143m1 Sm (t½ = 66 segundos) e 139m Sm (t½ = 10,7 segundos).
História

Detecção de elementos samário e afins foi anunciada por vários cientistas na segunda metade do século 19; no entanto, a maioria das fontes de dar a prioridade ao francês químico Paul Émile Lecoq de Boisbaudran. Boisbaudran isolado óxido de samário e / ou hidróxido em Paris , em 1879, a partir do mineral samarskite ((Y, Ce, U, Fe) 3 (Nb, Ta, Ti) 5 O 16) e identificou um novo elemento em que, através de linhas de absorção óptica afiadas. O químico suíço Marc Delafontaine anunciou um novo elemento decipium (do latim : decipiens que significa "enganador, enganosa") em 1878, mas mais tarde, em 1880-1881 demonstrou que era uma mistura de vários elementos, sendo um deles idêntico ao samário do Boisbaudran. Embora samarskite foi encontrado pela primeira vez na região russa remoto de Urais, no final da década de 1870 seus depósitos haviam sido localizados em outros lugares, tornando o mineral disponível para muitos pesquisadores. Em particular, verificou-se que o samário isolado por Boisbaudran também era impuro e continha quantidade comparável de európio . O elemento de puro foi produzido apenas em 1901 por Eugène-Anatole Demarçay.
Boisbaudran nomeou seu Samaria elemento após o samarskite mineral, que por sua vez homenageado Vasili Samarsky-Bykhovets (1803-1870). Samarsky-Bykhovets, como o Chefe do Estado Maior do russo acesso Corps of Engineers Mining, havia concedido por duas mineralogistas alemães, os irmãos Gustav Rose e Heinrich Rose, para estudar as amostras de minerais dos Urais. Neste sentido samário foi o primeiro elemento químico a ser nomeado após uma pessoa. Mais tarde, o nome usado por Samaria Boisbaudran foi transformado em samário, para estar em conformidade com os outros nomes de elementos, e Samaria nos dias de hoje é por vezes utilizado para se referir a óxido de samário, por analogia com ítria, zircónia, alumina , ceria, Holmia, etc. O símbolo Sm foi sugerido para samário; no entanto uma alternativa Sa era freqüentemente usado em vez até 1920.
Antes do advento de tecnologia de separação por permuta iónica na década de 1950, samário não tinha usos comerciais na forma pura. No entanto, um subproduto da purificação cristalização fraccionada de neodímio foi uma mistura de samário e gadolínio que adquiriu o nome de "Lindsay Mix", depois de a empresa que fez isso. Este material pensa-se que têm sido utilizados para nuclear hastes de controle em alguns dos primeiros reatores nucleares. Hoje em dia, um produto de base semelhante tem o nome "samário-europium- gadolínio "(SEG) concentrado. Ele é preparado por extracção com solvente a partir dos mistos lantanídeos isoladas de bastnäsite (ou monazite). Uma vez que os lantanídeos mais pesados têm a maior afinidade para o solvente utilizado, podem ser facilmente extraídos da massa usando proporções relativamente pequenas de solvente. Nem todos os produtores de terras raras que processam bastnäsite fazê-lo numa escala suficientemente grande para continuar a frente com a separação dos componentes da SEG, que, tipicamente, torna-se apenas um ou dois por cento de minério original. Tais produtores será, portanto, tornando SEG com vista à sua comercialização para os processadores especializados. Deste modo, o conteúdo valioso de európio, o minério é resgatado para uso em fabrico de fósforo. Samário purificação segue a remoção do európio. A partir de 2012, estando em excesso, óxido de samário é menos caro em escala comercial do que a sua abundância relativa no minério pode sugerir.
Ocorrência e produção

Com a concentração média de cerca de 8 partes por milhão (ppm), samário é o elemento mais abundante 40 na crosta da Terra. É o quinto lantanídeos mais abundante e é mais comum do que tal elemento como estanho. Concentração de samário em solos varia entre 2 e 23 ppm, e oceanos contêm cerca de 0,5-0,8 partes por trilhão. Distribuição de samário em solos depende fortemente do seu estado químico e é muito não homogéneo: em solos arenosos, samário concentração é cerca de 200 vezes maior na superfície das partículas do solo do que na água retida entre eles, e essa proporção pode ser superior a 1.000 em argilas.
Samário não é encontrado livre na natureza, mas, tal como outros elementos de terras raras, está contida em muitos minerais, incluindo monazita, bastnäsite, cerite, gadolinite e samarskite; monazite (em que o samário ocorre em concentrações de até 2,8%) e bastnäsite são utilizados principalmente como fontes comerciais. Recursos mundiais de samário são estimadas em dois milhões toneladas; eles estão localizados principalmente na China, Estados Unidos, Brasil, Índia, Sri Lanka e Austrália, ea produção anual é de cerca de 700 toneladas. Relatórios de produção País normalmente são dadas para todos os metais de terras raras combinados. De longe, a China tem a maior produção com 120 mil toneladas extraídas por ano; ele é seguido por os EUA (cerca de 5.000 toneladas) e da Índia (2.700 toneladas). Samário é geralmente vendido como óxido, o qual a um preço de cerca de 30 USD / kg é uma das mais baratas óxidos de lantanídeos. Enquanto que mischmetal - uma mistura de metais das terras raras, contendo cerca de 1% de samário - tem sido muito utilizado, samário relativamente pura foi isolada recentemente única, através processos de troca iônica, técnicas de extração de solvente, e deposição electroquimica. O metal é frequentemente preparada por electrólise de uma mistura fundida de samário (III) com cloreto de cloreto de sódio ou cloreto de cálcio . Samário também pode ser obtido através da redução do seu óxido com lantânio . O produto é então destilada para separar o samário (ponto de ebulição 1794 ° C) e lantânio (pb 3464 ° C).
Samário-151 é produzido em fissão nuclear de urânio com o rendimento de cerca de 0,4% do número total de eventos de fissão. Também é sintetizado mediante captura de neutrões de samário-149, que é adicionado ao hastes de controle de reatores nucleares. Consequentemente, samário-151 está presente no passado combustível nuclear e dos resíduos radioactivos.
Aplicações

Uma das aplicações mais importantes é na samário imans samário cobalto, que tem uma composição nominal de SmCo 5 ou Sm 2 Co 17. Eles têm alta magnetização permanente, o que é cerca de 10.000 vezes maior que a de ferro e só perde para a de ímãs de neodímio. No entanto, à base de samário imans têm maior resistência à desmagnetização, uma vez que são estáveis a temperaturas acima de 700 ° C (cf. 300-400 ° C durante magnetos de neodímio). Estes ímãs são encontrados em pequenos motores, fones de ouvido high-end magnética captadores para guitarras e instrumentos musicais relacionadas. Por exemplo, eles são utilizados nos motores de um energia solar aeronave elétrica Solar Challenger e no Samário cobalto silenciosas guitarra elétrica e baixo captadores.
Outra aplicação importante de samário e seus compostos é como catalisador e reagente químico. Catalisadores Samário ajudar decomposição de plásticos, dechlorination de poluentes, tais como bifenilos policlorados (PCBs), bem como a desidratação e desidrogenação de etanol. Samário (III), triflato (Sm (OTf) 3, Sm que é (CF 3 SO 3) 3) é um dos mais eficientes Os catalisadores ácidos de Lewis, por um halogéneo promoveu- Reacção de Friedel-Crafts com alcenos. Samário (II) é iodeto de um agente redutor e muito comum em acoplamento síntese orgânica, por exemplo, no reações desulfonylation; annulation; Danishefsky, Kuwajima, Mukaiyama e Sínteses totais Holton taxol; síntese total estricnina; Barbier reacção e outra reduções com samário (II) iodeto.
Na sua forma oxidada habitual, samário é adicionado para cerâmicas e vidros em que aumenta a absorção de luz infravermelha. Como um (menor) parte metal misto, samário é encontrada em " sílex "dispositivo de ignição de muitos isqueiros e lanternas.

Radioativo samário-153 é um emissor beta, com uma semi-vida de 46,3 horas. Ele é utilizado para matar as células cancerosas para o tratamento de cancro do pulmão , cancro da próstata, câncer de mama e osteossarcoma. Para este efeito, o samário-153 é quelatado com etilenodiamina tetrametileno fosfonato ( EDTMP) e injectado por via intravenosa. A quelação impede a acumulação de samário radioativo no corpo que resultaria em irradiação excessiva e geração de novas células cancerosas. A droga correspondente tem vários nomes, incluindo samário (153 Sm) lexidronam e seu nome comercial é Quadramet.
Samário-149 tem alta corte transversal para captura de nêutrons (41.000 celeiros) e, portanto, é usado nas barras de controle reatores nucleares. Sua vantagem em comparação com outros materiais concorrentes, tais como boro e cádmio, é a estabilidade de absorção - a maioria dos produtos de decaimento de fusão e de samário-149 são outros isótopos de samário, que também são bons absorvedores de nêutrons. Por exemplo, as seções transversais de samário-151 é de 15.000 celeiros, é da ordem de centenas de celeiros para o samário-150, 152, 153, e 6800 é para celeiros naturais (mixed-isótopos) de samário. Entre os produtos de decaimento em um reactor nuclear, samário-149 é considerado como o segundo mais importante para o projecto do reactor e depois de operação xenon-135.
Aplicações não comerciais e potenciais
Samário-dopado cristais de fluoreto de cálcio foram usadas como um meio activo em um dos primeiros lasers de estado sólido projetado e construído por Peter Sorokin (co-inventor do dye laser) e Mirek Stevenson na IBM laboratórios de pesquisa no início de 1961. pulsos de luz vermelha Este laser samário emitida a 708,5 nm. Tinha que ser arrefecido por hélio líquido e, portanto, não encontrou aplicações práticas.
Outro laser baseado samário tornou-se o primeiro saturado Laser de raios X a operar em comprimentos de onda mais curtos do que 10 nanômetros. Ele forneceu pulsos de 50 picossegundos em 7,3 e 6,8 nm adequado para aplicações em holografia, de alta resolução microscopia de espécimes biológicos, deflectometria, interferometria e A radiografia de plasmas densos relacionados com a fusão por confinamento e astrofísica . Operação saturado significa que a potência máxima possível foi extraída a partir do material gerador, resultando em alta a energia de pico de 0,3 mJ. A forma activa no plasma de samário foi produzido por irradiação de vidro revestido por samário com um infravermelhos pulsada Do laser de Nd-vidro (comprimento de onda ~ 1,05 mm).
A mudança de resistividade eléctrica em monochalcogenides samário pode ser utilizada num sensor de pressão ou num dispositivo de memória desencadeada entre uma baixa resistência e estado de alta resistência por pressão externa, e tais dispositivos estão a ser desenvolvidos comercialmente. Samário monossulfureto também gera tensão eléctrica mediante aquecimento moderado a cerca de 150 ° C que pode ser aplicado em conversores de energia termoelétrica.
A análise das concentrações relativas de samário e neodímio isótopos 147 Sm, Nd 144 e 143 Nd permite a determinação da idade e origem das rochas e meteoritos em samário-neodímio namoro. Ambos os elementos são lantanídeos e tem propriedades físicas e químicas muito semelhantes. Portanto, Sm-Nd namoro ou é insensível a uma compartimentação dos elementos do marcador durante vários processos geológicos, ou tal particionamento pode ser bem compreendido e modelado a partir do raios iónicos dos elementos envolvidos.
Problemas de saúde
Samário metal tem nenhum papel biológico no corpo humano. Os seus sais estimulam o metabolismo, mas não é claro se isto é o efeito de samário ou outros lantanídeos presente com ele. A quantidade total de samário em adultos é de cerca de 50 microgramas, principalmente no fígado e rins e com cerca de 8 microgramas por litro sendo dissolvido no sangue. Samário não é absorvido pelas plantas para uma concentração mensurável e, portanto, não é normalmente uma parte da dieta humana. No entanto, algumas plantas e vegetais pode conter até 1 parte por milhão de samário. Sais insolúveis de samário são não-tóxicos e os solúveis são apenas ligeiramente tóxico.
Quando ingerido, apenas cerca de 0,05% de sais de samário é absorvido para a corrente sanguínea e o restante é excretado. A partir do sangue, cerca de 45% vai para o fígado e 45% é depositado na superfície dos ossos, onde permanece durante cerca de 10 anos; o equilíbrio de 10% é excretado.

