
Rhenium
Fundo para as escolas Wikipédia
Crianças SOS têm produzido uma seleção de artigos da Wikipedia para escolas desde 2005. SOS Children trabalha em 45 países africanos; você pode ajudar uma criança em África ?
| Rhenium | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
75 Re | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Aparência | ||||||||||||||||||||||
branco prateado  | ||||||||||||||||||||||
| Propriedades gerais | ||||||||||||||||||||||
| Nome, símbolo, número | rênio, Re, 75 | |||||||||||||||||||||
| Pronúncia | / r Eu n Eu ə m / REE -nee-əm | |||||||||||||||||||||
| Categoria elemento | de metal de transição | |||||||||||||||||||||
| Grupo, período, bloco | 7, 6, d | |||||||||||||||||||||
| Peso atômico padrão | 186,207 | |||||||||||||||||||||
| Configuração eletrônica | [ Xe ] 4f 14 5d 5 6s 2 2, 8, 18, 32, 13, 2 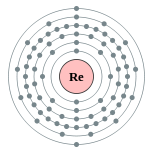 | |||||||||||||||||||||
| História | ||||||||||||||||||||||
| Descoberta | Masataka Ogawa (1908) | |||||||||||||||||||||
| Primeiro isolamento | Masataka Ogawa (1908) | |||||||||||||||||||||
| Nomeado por | Walter Noddack, Ida Noddack, Otto Berg (1922) | |||||||||||||||||||||
| Propriedades físicas | ||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||
| Densidade (perto RT) | 21,02 g · cm -3 | |||||||||||||||||||||
| Líquido densidade no pf | 18,9 g · cm -3 | |||||||||||||||||||||
| Ponto de fusão | 3459 K , 3186 ° C, 5767 ° F | |||||||||||||||||||||
| Ponto de ebulição | 5869 K, 5596 ° C, 10105 ° F | |||||||||||||||||||||
| Calor de fusão | 60,43 kJ mol -1 · | |||||||||||||||||||||
| Calor de vaporização | 704 kJ mol -1 · | |||||||||||||||||||||
| Capacidade calorífica molar | 25,48 J · · mol -1 K -1 | |||||||||||||||||||||
| Pressão de vapor | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Propriedades atômicas | ||||||||||||||||||||||
| Estados de oxidação | 7, 6, 5, 4, 3, 2, 1, 0, -1 (Moderadamente ácida óxido) | |||||||||||||||||||||
| Eletronegatividade | 1,9 (escala de Pauling) | |||||||||||||||||||||
| Energias de ionização ( Mais) | 1º: 760 kJ · mol -1 | |||||||||||||||||||||
| 2: 1260 kJ · mol -1 | ||||||||||||||||||||||
| 3: 2510 kJ · mol -1 | ||||||||||||||||||||||
| Raio atômico | 137 pm | |||||||||||||||||||||
| O raio de covalência | 151 ± 19:00 | |||||||||||||||||||||
| Miscelânea | ||||||||||||||||||||||
| A estrutura de cristal | hexagonal repleto de perto | |||||||||||||||||||||
| Ordenamento magnético | paramagnético | |||||||||||||||||||||
| Resistividade elétrica | (20 ° C) 193 Nco · m | |||||||||||||||||||||
| Condutividade térmica | 48,0 W · m -1 · K -1 | |||||||||||||||||||||
| Expansão térmica | 6,2 mm / (m · K) | |||||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C) 4700 m · s -1 | |||||||||||||||||||||
| O módulo de Young | 463 GPa | |||||||||||||||||||||
| Módulo de cisalhamento | 178 GPa | |||||||||||||||||||||
| Massa de módulo | 370 GPa | |||||||||||||||||||||
| Rácio de Poisson | 0,30 | |||||||||||||||||||||
| Dureza de Mohs | 7 | |||||||||||||||||||||
| Dureza de Vickers | 2.450 MPa | |||||||||||||||||||||
| Dureza Brinell | 1.320 MPa | |||||||||||||||||||||
| Número de registo CAS | 7440-15-5 | |||||||||||||||||||||
| A maioria dos isótopos estáveis | ||||||||||||||||||||||
| Ver artigo principal: Isótopos de rénio | ||||||||||||||||||||||
| ||||||||||||||||||||||
Rênio é um elemento químico com o símbolo Re e número atômico 75. É um, pesado, da terceira fileira branco prateado de metal de transição em grupo 7 da tabela periódica . Com uma concentração média estimada de 1 parte por bilhão (ppb), rênio é um dos elementos mais raros no crosta terrestre . O elemento livre tem a terceiro maior ponto de fusão e ponto mais alto de qualquer elemento de ebulição. Rénio se assemelha manganês quimicamente e é obtido como um subproduto do molibdênio e cobre extração de minério e requinte. Rénio mostra nos seus compostos uma ampla variedade de estados de oxidação que varia de -1 a +7.
Descoberto em 1925, o rênio foi a última elemento estável para ser descoberto. Foi nomeado após o rio Rhine na Europa.
Nickel baseados superligas de rénio são usadas nas câmaras de combustão, as lâminas de turbina, e bocais de escape de motores a jacto , estas ligas contêm até 6% de rénio, tornando a construção do motor a jacto de maior uso único para o elemento, com utilizações catalíticas da indústria química sendo NEXT- mais importante. Devido à baixa disponibilidade em relação à demanda, rênio está entre o mais caro dos metais, com um preço médio de cerca de 4,575 $ US por quilograma (US $ 142,30 por onça troy) a partir de agosto de 2011; é também de fundamental importância militar estratégica é, para seu uso em motores militares de alto desempenho jato e foguetes.
História
Rênio ( Latin : Rhenus significado: " Reno ") foi o último elemento a ser descoberto com um isótopo estável (outros novos elementos radioativos foram descobertos na natureza, desde então, como neptunium e plutónio ). A existência de um elemento de ainda não descoberto nesta posição na tabela periódica tinha sido previsto pela primeira vez por Dmitry Mendeleev . Outras informações calculada foi obtida Henry Moseley em 1914. Considera-se geralmente ter sido descoberto por Walter Noddack, Ida Tacke, e Otto Berg na Alemanha . Em 1925 eles relataram que eles detectaram o elemento em minério de platina e no mineral columbita. Eles também descobriram rênio em gadolinite e molibdenita. Em 1928 foram capazes de extrair de 1 g do elemento de processamento de 660 kg de molybdenite.It foi estimada em 1968 que 75% do metal de rénio no Estados Unidos foi utilizado para a pesquisa e o desenvolvimento de ligas metálicas refractárias. Foram necessários vários anos a partir desse ponto antes das superligas se tornou amplamente utilizado.
Em 1908, japonês químico Masataka Ogawa anunciou que descobriu o elemento 43 e nomeou-nipponium (Np) após o Japão (Nippon em japonês). No entanto, mais tarde, a análise indicou a presença de óxido de rénio (elemento 75), não elemento 43 . O símbolo Np foi utilizado mais tarde para o elemento Neptúnio .
Características
Rênio é um metal prateado-branco com um dos mais altos pontos de fusão de todos os elementos, ultrapassado por apenas tungstênio e carbono . É também uma das mais densas, superado apenas pelo de platina , irídio e ósmio . Rhenium tem uma estrutura cristalina hexagonal cheio de perto, com parâmetros de rede a = 276,1 pm e c = 445,6 pm.
A sua forma comercial comum é um pó, mas este elemento pode ser consolidada por prensagem e sinterização no vácuo ou de hidrogénio atmosfera. Este procedimento produz um sólido compacto com uma densidade superior a 90% da densidade do metal. Quando recozido este metal é muito maleável e pode ser dobrado, enrolado, ou laminados. Rênio-molibdênio ligas são supercondutores a 10 K ; ligas de tungsténio-rénio também são supercondutores em torno de 08/04 K, dependendo da liga. Metais Rhenium superconducts em 1,697 ± 0,006 K.
Na forma a granel e à temperatura ambiente e à pressão atmosférica, o elemento resiste álcalis, ácido sulfúrico , ácido clorídrico , diluído, mas não concentrada de ácido nítrico , e água régia.
Isótopos
Rhenium tem um isótopo estável, rênio-185, que, no entanto, ocorre em abundância minoria, uma situação encontrada apenas em dois outros elementos ( índio e telúrio ). Que ocorre naturalmente é o rénio Re 185 37,4%, que é estável , e 62,6% 187 Re, que é instável, mas tem um tempo muito longo de semi-vida (10 ~ 10 anos). Este tempo de vida é afectada pelo estado de carga do átomo de rénio. O decaimento beta de 187 Re é usado para rênio-ósmio namoro de minérios. A energia disponível para este decaimento beta (2,6 keV) é um dos mais baixos conhecido entre todos radionuclídeos. Há vinte e seis outros isótopos radioativos reconhecidos de rênio.
Compostos
Compostos de rênio são conhecidos por todos os nove estados de oxidação entre -1 e 7. Os estados de oxidação 7, 6, 4 e 2 são os mais comuns. Rénio é mais disponível comercialmente na forma de sais de perrenato, incluindo de sódio e perrhenates amónio. Estes são, compostos solúveis em água branca.
Halogenetos e oxi-
Os cloretos de rênio mais comuns são RECL 6, Recl 5, Recl 4, e RECL 3. As estruturas destes compostos apresentam frequentemente extensa ligação re-re, que é característica deste metal em estados de oxidação mais baixos do que VII. Sais de [Re 2 Cl 8] 2- característica uma ligação metal-metal quádruplo. Embora a maior cloreto de rénio apresenta Re (VI), flúor dá o d 0 Re (VII) derivado heptafluoride rênio. Os brometos e iodetos de rénio são também bem conhecidos.
Como tungstênio e molibdênio, com o qual compartilha semelhanças químicas, rênio forma uma variedade de oxihaletos. Os oxicloretos são mais comuns, e incluem ReOCl 4, ReO 3 Cl.
Óxidos e sulfuretos

O óxido mais comum é o volátil incolor Re 2 O 7, que adopta uma estrutura molecular, contrariamente à maioria dos óxidos de metal. A espécie d1 ReO 3 adota uma estrutura perovskita defeito. Outros óxidos incluem Re 2 O 5, ReO 2, e Re 2 O 3. O sulfetos são 2 e ReS Re 2 S 7. Perrenato sais podem ser convertidos em tetrathioperrhenate pela acção de hydrosulfide amónio.
Outros compostos
Diboreto de rénio (REB 2) é um composto duro tendo a dureza semelhante àquele de carboneto de tungstênio, carboneto de silício, diboreto de titânio ou diboreto de zircónio.
Compostos Organorhenium
Decacarbonyl Dirhenium é a entrada mais comum de organorhenium química. A sua redução com sódio amálgama dá Na [Re (CO) 5] com rénio no estado de oxidação formal -1. Dirhenium decacarbonyl pode ser oxidado com bromo para bromopentacarbonylrhenium (I):
- Re 2 (CO) 10 + Br 2 → 2 Re (CO) 5 Br
A redução deste pentacarbonilo com zinco e ácido acético dá pentacarbonylhydridorhenium:
- Re (CO) 5 Br + Zn + HOAc → Re (CO) 5 H + ZnBr (OAc)
Methylrhenium trióxido ("OMP"), CH 3 ReO 3 é uma volátil, sólido incolor foi usado como um catalisador em algumas experiências laboratoriais. Ele pode ser preparado por muitas rotas, um método típico é a reacção de Re 2 O 7 e tetrametilestanho:
- Re 2 O 7 + (CH3) 4Sn → CH3 ReO 3 + (CH3) 3 3 SnOReO
Derivados alquilo e arilo são conhecidos análogos. MTO catalisa para as oxidações com peróxido de hidrogênio . Terminal alcinos se obter o correspondente ácido ou éster, dicetonas rendimento internos alcinos, e alcenos dar epóxidos. OMP também catalisa a conversão de aldeídos e diazoalcanos em um alceno.
Nonahydridorhenate

9.
Um derivado de rénio é distintivo nonahydridorhenate, originalmente pensado para ser o ânion rhenide, Re -
, Mas, na verdade, contendo a ReH 2-
9 ânion em que o estado de oxidação do rênio é sete.
Ocorrência

Rênio é um dos elementos mais raros em crosta terrestre com uma concentração média de 1 ppb; outras fontes de citar o número de 0,5 ppb tornando-se o elemento mais abundante 77 na crosta da Terra. Rênio, provavelmente, não é encontrado livre na natureza (sua possível ocorrência natural é incerto), mas ocorre em quantidades até 0,2% no mineral molibdenite (que é principalmente dissulfeto de molibdênio), a principal fonte comercial, embora as amostras de molibdenite individuais com até 1,88% foram encontrados. Chile tem as maiores reservas de rênio do mundo, parte dos depósitos de minério de cobre, e foi o primeiro produtor a partir de 2005. Foi apenas recentemente que o primeiro rénio mineral foi encontrada e descrita (em 1994), um rénio de mineral de sulfureto (Res 2) a condensação de um fumarola na Rússia 's Kudriavy vulcão, Ilha Iturup, no Ilhas Kurilas. Kudryavy descarrega até 20-60 kg rênio por ano na maior parte sob a forma de rênio dissulfeto. Nomeado rheniite, este mineral raro comanda preços elevados entre os colecionadores.
Produção

Rênio comercial é extraído do gás de combustão torrador-molibdênio obtido a partir de minérios de cobre e sulfureto. Alguns minérios de molibdênio contêm 0,001% a 0,2% rênio. Rénio (VII) e óxido de ácido perrhenic facilmente dissolver em água; eles são lixiviados a partir de poeiras e gases de combustão e extraiu-se por precipitação com de potássio ou de cloreto de amónio, como o sais perrenato, e purificou-se por recristalização. A produção total mundial é entre 40 e 50 toneladas / ano; os principais produtores estão em Chile, Estados Unidos, Peru e Cazaquistão. Reciclagem de ligas Pt-Re catalisador e especiais usados permitir a recuperação de mais 10 mil toneladas por ano. Os preços para o metal subiu rapidamente no início de 2008, de US $ 1000- $ 2000 por kg em 2003-2006 para mais de US $ 10.000 em fevereiro de 2008. A forma de metal é preparado por redução perrenato de amónio com hidrogénio a altas temperaturas:
- 2 NH ReO 4 + 4 7 H 2 → 2 Re 8 + H2O + 2 NH3
Aplicações

Rénio é adicionado para superligas de alta temperatura que são usados para fazer motores a jacto partes, utilizando 70% da produção de rénio em todo o mundo. Outra aplicação importante é em platina-rénio catalisadores , que são usados principalmente na tomada de chumbo -livre, de alta octanagem gasolina.
Alloys
A base de níquel- superligas melhoraram rastejar resistência com a adição de óxido de rénio. As ligas normalmente contêm 3% ou 6% de rénio. Ligas de segunda geração contêm 3%; estas ligas foram usadas nos motores do F-16 e F-15, ao passo que um único cristal ligas mais recentes terceira geração contêm 6% de óxido de rénio; eles são usados na F-22 e F-35 motores. Rénio é também usado nas superligas, tal como CMSX-4 (segunda geração) e CMSX-10 (3 Gen) que são utilizados em aplicações industriais turbinas a gás como a GE 7FA. Rénio pode causar superligas para se tornar microestruturalmente instável, formando TCP indesejável (topologicamente perto embalados) fases . Na 4ª e 5ª geração superligas, ruténio é usada para evitar este efeito. Entre outros, o novo superligas são EPM-102 (com 3% de Ru) e TMS-162 (com 6% de Ru), ambos contendo 6% de rénio, bem como TMS-138 e TMS-174.

Para 2006, o consumo é dado como 28% para General Electric, 28% Rolls-Royce plc e 12% Pratt & Whitney, tudo para superligas, enquanto o uso de catalisadores representa apenas 14% e as restantes aplicações utilizar 18%. Em 2006, 77% do consumo de rénio nos Estados Unidos foi em ligas. A crescente demanda por motores a jato militares eo fornecimento constante tornou-se necessário desenvolver superligas com um teor de rênio inferior. Por exemplo, o mais recente CFM International CFM56 turbina de alta pressão (HPT) lâminas usará Rene N515 com um teor de rénio de 1,5% em vez de Rene N5 com 3%.
Rénio melhora as propriedades de tungsténio . Ligas de tungstênio-rênio são mais dúctil a baixa temperatura, o que lhes permite ser mais facilmente usinado. A estabilidade a temperaturas elevadas também é melhorada. O efeito aumenta com a concentração de rénio, e, por conseguinte, as ligas de tungsténio são produzidos com até 27% de Re, que é o limite de solubilidade. Uma aplicação para as ligas de tungstênio-rênio é Fontes de raios-X. O elevado ponto de fusão de ambos os compostos, em conjunto com a alta massa atómica, torna-as estáveis contra o impacto de electrões prolongada. Ligas de tungstênio rênio também são aplicadas como termopares para medir temperaturas até 2200 ° C .
A estabilidade de alta temperatura, baixa pressão de vapor, boa resistência ao desgaste e capacidade de resistir à corrosão arco de rénio são úteis em auto-limpeza contatos elétricos. Em particular, a descarga ocorre durante a comutação oxida os contatos. No entanto, o óxido de rénio Re 2 O 7 tem fraca estabilidade (sublima a ~ 360 ° C) e, por conseguinte, é removido durante a descarga.
Rénio tem um ponto de fusão elevado e uma baixa pressão de vapor semelhante ao tântalo e tungsténio. Por conseguinte, os filamentos de rénio apresentam uma estabilidade mais elevada, se o filamento não é operado em vácuo, mas em atmosfera que contém oxigénio. Esses filamentos são amplamente utilizados em espectrómetros de massa , em medidores de iões e lâmpadas Photoflash em fotografia .
Catalisadores
Rénio, sob a forma de liga de platina-rénio é usado como catalisador para a reformação catalítica, o que é um processo químico para converter refinaria de petróleo naftas com baixa octanagem em produtos líquidos de alta octanagem. Em todo o mundo, 30% de catalisadores utilizados para este processo contêm rénio. O metátese de olefinas é a outra reacção para os quais o rénio é utilizado como catalisador. Normalmente Re 2 O 7 em alumina é utilizado para este processo. Catalisadores de rénio são muito resistentes à envenenamento químico a partir de azoto, enxofre e fósforo, e assim são utilizados em certos tipos de reacções de hidrogenação.
Outros usos
188 Re e 186 Re isótopos são radioativos e são utilizados para o tratamento de câncer de fígado. Ambos têm profundidade de penetração semelhante em tecido (5 milímetros para 186 Re e 11 mm para 188 Re), mas 186 Re tem a vantagem de uma vida mais longa (90 horas contra 17 horas).
Relatado por tendências periódicas, rénio tem uma química semelhante com tecnécio ; trabalho feito com a gravadora rênio para compostos alvo muitas vezes pode ser traduzido para o tecnécio. Isto é útil para radiopharmacy, onde é difícil de se trabalhar com tecnécio - 99m, especialmente o isótopo utilizado em medicina - devido ao seu custo e meia-vida curta.
Precaução
Muito pouco se sabe sobre a toxicidade de rénio e seus compostos, porque eles são utilizados em quantidades muito pequenas. Os sais solúveis, tais como os haletos de rénio ou perrhenates, poderiam ser perigosos devido a outros elementos de rénio ou devido ao próprio rénio. Apenas alguns compostos de rénio foram testadas quanto à sua toxicidade aguda; dois exemplos são perrenato de potássio e tricloreto de rénio, que foram injectados como uma solução em ratos. O perrenato tinha um LD 50 valor de 2,800 mg / kg após sete dias (isto é muito baixa toxicidade, semelhante ao do sal de mesa) e o tricloreto de rénio mostrou LD 50 de 280 mg / kg.
