
Polônio
Informações de fundo
Crianças SOS tentou tornar o conteúdo mais acessível Wikipedia por esta selecção escolas. Patrocinar uma criança para fazer uma diferença real.
| Polônio | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
84 Po | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||||
argênteo  | |||||||||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||||||||
| Nome, símbolo, número | polônio, Po, 84 | ||||||||||||||||||||||||||||||
| Pronúncia | / p ɵ l oʊ n Eu ə m / po- LOH -nee-əm | ||||||||||||||||||||||||||||||
| Categoria elemento | metais de transição pós- Status de metal pós-transição é contestado (ver texto do artigo) | ||||||||||||||||||||||||||||||
| Grupo, período, bloco | 16 (Calcogênios), 6, p | ||||||||||||||||||||||||||||||
| Peso atômico padrão | (209) | ||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Xe ] 6s 2 4f 14 5d 10 6p 4 2, 8, 18, 32, 18, 6  | ||||||||||||||||||||||||||||||
| História | |||||||||||||||||||||||||||||||
| Descoberta | Pierre Curie e Marie Curie (1898) | ||||||||||||||||||||||||||||||
| Primeiro isolamento | Willy Marckwald (1902) | ||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||
| Densidade (perto RT) | (Alpha) 9,196 g · cm -3 | ||||||||||||||||||||||||||||||
| Densidade (perto RT) | (Beta) 9,398 g · cm -3 | ||||||||||||||||||||||||||||||
| Ponto de fusão | 527 K , 254 ° C, 489 ° F | ||||||||||||||||||||||||||||||
| Ponto de ebulição | 1235 K, 962 ° C, 1764 ° F | ||||||||||||||||||||||||||||||
| Calor de fusão | ca. 13 kJ mol -1 · | ||||||||||||||||||||||||||||||
| Calor de vaporização | 102,91 kJ mol -1 · | ||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 26,4 J · · mol -1 K -1 | ||||||||||||||||||||||||||||||
| Pressão de vapor | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||||||||
| Estados de oxidação | 6, 4, 2, -2 ( óxido anfotérico) | ||||||||||||||||||||||||||||||
| Eletronegatividade | 2,0 (escala de Pauling) | ||||||||||||||||||||||||||||||
| Energias de ionização | 1º: 812,1 kJ · mol -1 | ||||||||||||||||||||||||||||||
| Raio atômico | 168 pm | ||||||||||||||||||||||||||||||
| O raio de covalência | 140 ± 16:00 | ||||||||||||||||||||||||||||||
| Van der Waals raio | 197 pm | ||||||||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||||||||
| A estrutura de cristal | cúbico 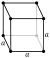 | ||||||||||||||||||||||||||||||
| Ordenamento magnético | nonmagnetic | ||||||||||||||||||||||||||||||
| Resistividade elétrica | (0 ° C) (α) 0,40 μΩ · m | ||||||||||||||||||||||||||||||
| Condutividade térmica | ? 20 W · m -1 · K -1 | ||||||||||||||||||||||||||||||
| Expansão térmica | (25 ° C) de 23,5 pM · · K -1 m -1 | ||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-08-6 | ||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de polónio | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
O polônio é um elemento químico com o símbolo Po e número atômico 84, descoberto em 1898 por Marie e Pierre Curie. Um raro e altamente elemento radioativo sem estável isótopos, o polônio é quimicamente similar ao bismuto e telúrio , e ocorre em urânio minérios. Aplicações de polônio são poucos, e incluem aquecedores em sondas espaciais, dispositivos anti-estáticos, e as fontes de neutrões e partículas alfa. Devido à sua posição na tabela periódica, polônio é por vezes classificadas como um metalóide. No entanto, outras fontes de dizer que na base das suas propriedades e do comportamento, é "sem ambiguidade um metal".
Características
Isótopos
O polônio tem 33 isótopos conhecidos, todos os quais são radioactivo. Eles têm massas atômicas que variam 188-220 u. 210 Po (meia-vida 138,376 dia) é o mais amplamente disponível. Po 209 (semi-vida de 103 anos) e 208 PO (meia-vida de 2,9 anos), pode ser feita através do alfa, protão, ou bombardeamento de deutério de chumbo ou bismuto numa ciclotrão.
210 Po é um alfa emissor que tem uma meia-vida de 138,4 dias; ele decai diretamente para seu estábulo filha isótopo, 206 Pb . Um miligrama de 210 Po emite cerca de tantas partículas alfa por segundo como 5 gramas de 226 Ra . Poucos curies (1 curie é igual a 37 gigabecquerels, 1 Ci = 37 GBq) de 210 Po emitem um brilho azul, que é causada por de excitação de ar circundante.
Cerca de uma em 100.000 emissões alfa provoca uma excitação no núcleo que depois resulta na emissão de raios gama com uma energia máxima de 803 keV. No entanto, é que as partículas alfa e não o efeito lateral de um raio gama ocasional, que resulta em 210 Po deterioração. O nível de radiação gama do polônio é inferior ao fundo normal.
Forma no estado sólido

O polônio é um elemento radioactivo que existe em duas metálicos allotropes . A forma alfa é o único exemplo conhecido de um simples estrutura de cristal cúbica em uma única base átomo, com um comprimento de aresta de 335,2 picometros; a forma beta é rhombohedral. A estrutura de polônio tem sido caracterizada por raios-X e difracção difracção de electrões.
210 Po (em comum com Pu 238) tem a capacidade para ser transportada pelo ar com facilidade: se uma amostra é aquecida em ar a 55 ° C (131 ° F), 50% do mesmo é vaporizado em 45 horas, embora o ponto de fusão é polônio 254 ° C (489 ° F) e o seu ponto de ebulição é de 962 ° C (1763 ° F). Existe mais de uma hipótese de como o polônio faz isso; uma sugestão é que pequenos aglomerados de átomos de polônio são spalled off pelo decaimento alfa.
Química
A química de polônio é semelhante ao de telúrio e bismuto. Polónio dissolve prontamente diluídas em ácidos , mas é apenas ligeiramente solúvel em álcalis. Soluções de polônio são coloridas pela primeira vez em rosa pelos 2+ Po, mas, em seguida, tornar-se rapidamente amarelo porque a radiação do polônio alfa ioniza o solvente e converte Po Po 2+ para 4+. Este processo é acompanhado por borbulhamento e a emissão de calor e luz por material de vidro, devido às partículas alfa absorvidos; como resultado, as soluções polônio são voláteis e evapora-se dentro de alguns dias, a menos que selado.
Tem sido relatado que alguns micróbios podem polônio metilato pela acção de methylcobalamin. Isto é semelhante à maneira pela qual o mercúrio , selénio e telúrio são metilados nos seres vivos para criar compostos organometálicos. Como resultado, quando considerando a bioquímica do polônio deve-se considerar a possibilidade de que o polônio seguirá os mesmos caminhos bioquímicos como o selênio e telúrio.
Compostos
Polônio não tem compostos comuns, únicos sinteticamente criadas, e mais de 50 desses são conhecidos. A classe mais estável de compostos de polônio são polonides, que são preparados por reacção directa de dois elementos. Na 2 Po tem a estrutura antifluorite, os polonides de Ca, Ba, Hg, Pb e lantanídeos formam uma rede de NaCl, Bepo e CDPO têm a wurtzite e MgPo o estrutura arsenieto de níquel. A maioria dos polonides decompor por aquecimento a cerca de 600 ° C, excepto para HgPo que se decompõe a ~ 300 ° C e os polonides lantanídeos, que não se decompõem, mas fundem a temperaturas superiores a 1000 ° C. Por exemplo PrPo funde a 1250 ° C e TMPO a 2200 ° C.
Polónio hidreto (PoH 2) é um líquido volátil à temperatura ambiente propenso a dissociação. Os dois óxidos Poo 2 e Poo 3 são os produtos de oxidação de polônio.
Halides do Pox estrutura Pox 2, Pox 4 e 6 são conhecidos. Eles são solúveis nos correspondentes halogenetos de hidrogénio, por exemplo, POCl X em HCl, POBr X em HBr e PGI 4 em HI. Di-halogenetos de polónio são formados por reacção directa dos elementos ou por redução de POCl 4 com SO2 e com POBr 4 com H 2 S a temperatura ambiente. Tetra-halogenetos pode ser obtido por reacção de dióxido de polônio com HCl, HBr ou Hl.
Outros compostos incluem polônio etilo, bromato, carbonato , citrato, cromato, cianeto, formato, hidróxido, nitrato , selenato, monossulfureto, sulfato e dissulfato.
| Fórmula | Cor | p.f. (° C) | Sublimação Temp. (° C) | Simetria | Símbolo Pearson | Grupo espacial | Não | A (pm) | b (pm) | c (h) | Z | ρ (g / cm 3) | ref |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Poo 2 | amarelo pálido | 500 (dec). | 885 | FCC | Fm 3 m | CF12 | 225 | 563,7 | 563,7 | 563,7 | 4 | 8.94 | |
| PoCL 2 | vermelho escuro | 355 | 130 | orthorhombic | o P3 | PMMM | 47 | 367 | 435 | 450 | 1 | 6.47 | |
| POBr 2 | roxo-marrom | 270 (dec). | |||||||||||
| PoCL 4 | amarelo | 300 | 200 | monoclinic | |||||||||
| POBr 4 | vermelho | 330 (dec). | FCC | Fm 3 m | CF100 | 225 | 560 | 560 | 560 | 4 | |||
| PGI 4 | preto |
Óxidos
| Hidretos
| Halogênio compostos
|
História
Também provisoriamente chamado " Radium F ", polónio foi descoberto por Marie e Pierre Curie, em 1898, e foi nomeado após terra natal de Marie Curie de Poland ( Latin : Polonia) Polônia na época estava sob russa, prussiana e austríaca particionar, e não existia como um país independente. Era a esperança de Curie que nomear o elemento após sua terra natal seria divulgar sua falta de independência. O polônio pode ser o primeiro elemento nomeado para realçar uma controvérsia política.
Este elemento foi o primeiro descoberto pelo casal Curie quando investigavam a causa da pechblenda radioactividade. A pechblenda, após a remoção dos elementos radioactivos de urânio e tório , era mais radioativo que tanto o urânio e tório juntos. Isso impulsionou os Curie sobre para encontrar elementos radioativos adicionais. Os Curie separadas pela primeira vez polónio do uraninita em julho de 1898, e cinco meses depois, também isolado o rádio .
Nos Estados Unidos, polónio foi produzido como parte da Projeto Manhattan durante a Segunda Guerra Mundial. Era uma parte crítica do de implosão projeto arma nuclear usado na Fat Man bomba em Nagasaki em 1945. O polônio e berílio foram os principais ingredientes do ' Detonador Urchin 'no centro do esférico da bomba Pit plutônio. Ouriço-do-inflamado a reacção em cadeia nuclear no momento da prompt da criticidade para garantir que a bomba não chiadeira.
Grande parte da física básica de polónio foi classificadas até depois da guerra. O fato de que ele foi usado como um iniciador foi classifed até os anos 1960.
O Comissão eo da Energia Atómica Manhattan Projeto financiado experiências humanas utilizando polônio em 5 pessoas na Universidade de Rochester entre 1943 e 1947. As pessoas foram administradas entre 9 e 22 microcuries de polónio para estudar a sua excreção.
Detecção

Gamma contagem
Por meio de métodos radiométricos como espectrografia de raios gama (ou um método utilizando uma separação química, seguido de um medição da actividade com um contador-não-dispersiva de energia), é possível medir as concentrações de radioisótopos e de distinguir um do outro. Na prática, o ruído de fundo iria estar presente e, dependendo do detector, a largura da linha seria maior que o tornem mais difícil de identificar e medir o isótopo . Em trabalho biológica / médico, é comum utilizar o singular 40 K presente em todos os fluidos de tecidos / corpo como uma verificação do equipamento e, como um padrão interno.


Alpha contagem
A melhor maneira de testar (e medir) muitos emissores alfa é usar espectroscopia de partículas alfa, uma vez que é comum colocar uma gota da solução de ensaio num disco de metal que é, em seguida, secou-se para dar um revestimento uniforme sobre o disco. Este é então utilizado como amostra de teste. Se a espessura da camada formada no disco for demasiado espessa, então as linhas de espectro alargado são, isso é porque uma parte da energia do partículas alfa é perdida durante o seu movimento através da camada de material activo. Um método alternativo é a utilização de cintilação líquida interna, onde a amostra é misturada com um cocktail de cintilação. Quando a luz emitida é então contado, algumas máquinas vão registrar a quantidade de energia luminosa por evento decaimento radioativo. Devido às imperfeições do processo de cintilação líquida (tal como uma falha de todas as fotões a ser detectada, amostras turva ou colorida pode ser difícil contar) e o facto de têmpera aleatório pode reduzir o número de fotões gerados por decaimento radioactivo é possível obter um alargamento do espectro de alfa obtido através de cintilação líquida. É provável que estes espectros de cintilação líquida irá estar sujeito a uma Alargamento Gaussiana, em vez de a distorção exibido quando a camada de material activo de um disco for muito espessa.
Um método de energia dispersiva terceira para a contagem de partículas alfa é a utilização de um detector semicondutor.
Da esquerda para a direita, os picos são devidas a 209 Po, Po 210, 239 e 241 Pu Am. O facto de isótopos tais como Pu 239 e 241 Am têm mais de uma linha de alfa indica que o núcleo tem a capacidade de ser diferente em discreta níveis de energia (como uma molécula pode).
Ocorrência e produção
Polónio é um elemento muito rara na natureza, devido à curta semi-vida de todos os seus isótopos. Encontra-se em urânio minérios em cerca de 0,1 mg por tonelada métrica (1 parte em 10 10), que é de aproximadamente 0,2% da abundância de rádio. Os montantes em crosta da Terra não são prejudiciais. O polônio foi encontrado na fumaça do tabaco a partir de folhas de tabaco cultivadas com fertilizantes fosfatados.
Por causa da pequena abundância, o isolamento de polônio partir de fontes naturais é um processo muito tedioso. O maior lote foi extraído na primeira metade do século 20 pelo processamento de 37 toneladas de resíduos da produção de rádio. Ele continha apenas 40 Ci (9 mg) de polônio-210. Hoje em dia, o polônio é obtido através da irradiação de bismuto com nêutrons de alta energia ou prótons.
Captura de neutrões
- Síntese de (n, γ) reacção
Em 1934, um experimento mostrou que, quando natural, 209 Bi é bombardeado com nêutrons , 210 Bi é criado, que então decai para 210 Po via decaimento β. A purificação final é feita pyrochemically seguido por técnicas de extracção líquido-líquido. O polônio pode ser feita em quantidades de miligramas mediante este procedimento, usando o fluxo elevado de nêutrons encontrados em reatores nucleares. Apenas cerca de 100 gramas são produzidas a cada ano, praticamente todo ele na Rússia, fazendo polônio extremamente raros.
Este processo pode causar problemas em chumbo-bismuto Based metal líquido arrefecido reactores nucleares, tais como os utilizados na Soviética Marinha K-27. Devem ser tomadas medidas nestes reactores para lidar com a possibilidade indesejável de 210 Po de ser libertado a partir do líquido de arrefecimento.
Captura de protões
- Síntese por (p, n) e (p, 2 N) Reacções
Verificou-se que os isótopos de vida mais longa de polônio pode ser formado por protões bombardeamento de bismuto usando um ciclotrão. Outros mais isótopos ricos em neutrões pode ser formado pela irradiação de platina com carbono núcleos.
Aplicações
Fontes baseadas polônio de partículas alfa foram produzidos na antiga União Soviética. Tais fontes foram aplicados para medir a espessura de revestimentos industriais através de atenuação da radiação alfa. Por causa da radiação alfa intenso, uma amostra de um grama de 210 Po vai aquecer espontaneamente até acima de 500 ° C (932 ° F), gerando cerca de 140 watts de energia. Portanto, 210 Po é usado como uma fonte de calor atômico ao poder geradores termoelétricos de radioisótopos via materiais termoelétricos. Por exemplo, fontes de calor 210 Po foram usadas na Lunokhod 1 (1970) e Lunokhod 2 (1973) Lua rovers para manter seus componentes internos quente durante as noites lunares, assim como a Kosmos 84 e 90 satélites (1965).
As partículas alfa emitidas pelos polônio pode ser convertido aos neutrões usando óxido de berílio, a uma taxa de 93 neutrões por milhão de partículas alfa. Assim, misturas Po-Beo ou ligas são usados como um fonte de neutrões, por exemplo, numa gatilho de nêutrons ou iniciador de armas nucleares e para a inspecção de poços de petróleo. Cerca de 1500 de tais fontes com uma atividade individual de 1850 Ci têm sido utilizados anualmente na União Soviética.
O polônio também foi parte de escovas ou ferramentas mais complexas que eliminam cargas estáticas em placas fotográficas, têxteis moinhos, rolos de papel, plástico em folha, e em substratos antes da aplicação de revestimentos (como o automotivo). As partículas alfa emitidas por polônio ionizar moléculas de ar que neutralizam cargas nas superfícies próximas. No entanto, polônio precisa de ser substituído nestes dispositivos de quase todos os anos devido à sua curta semi-vida; é também altamente radioactivos e, portanto, foi substituído na maior parte pelo menos perigoso fontes de partículas beta.
Toxicidade
Visão global
O polônio é altamente perigoso e não tem nenhum papel biológico. Por massa, o polônio-210 é cerca de 250.000 vezes mais tóxico do que o cianeto de hidrogênio (o real LD 50 para 210 Po é inferior a 1 micrograma para um adulto médio (ver abaixo), em comparação com cerca de 250 miligramas ) de cianeto de hidrogénio. O principal risco é a sua radioatividade intensa (como um emissor alfa), o que torna muito difícil de lidar com segurança. Mesmo nas quantidades de microgramas, manipulação 210 Po é extremamente perigoso, exigindo equipamento especializado (a alfa pressão negativa caixa de luva equipada com filtros de alto desempenho), o monitoramento adequado e procedimentos de manuseio rigorosas para evitar qualquer contaminação. As partículas alfa emitidas por polônio irá danificar o tecido orgânico facilmente se polônio é ingerido, inalado ou absorvido, embora eles não penetram na epiderme e, por conseguinte, não são perigosos, desde que as partículas alfa permanecem fora do corpo. Enquanto isso, vestindo quimicamente resistente e luvas "intactas" é uma precaução obrigatória para evitar transcutânea difusão de polônio diretamente através do pele. Polônio entregue em concentrado de ácido nítrico pode facilmente difundir através de luvas inadequadas (por exemplo, luvas de látex) ou o ácido pode danificar as luvas.
Efeitos agudos
O dose letal média (DL50) para exposição à radiação aguda é geralmente de cerca de 4,5 Sv. O dose efetiva comprometida equivalente 210 Po é de 0,51 μSv / Bq se ingerido, e 2,5 μSv / Bq se inalado. Desde 210 Po tem uma atividade de 166 TBq por grama (4500 Ci / g) (1 grama produz 166 × 10 12 desintegrações por segundo), uma fatal 4,5 Sv (J / kg) de dose pode ser causada pela ingestão de 8,8 MBq (238 micro curies, uCi), cerca de 50 nanogramas (ng), ou inalar 1,8 MBq (48 uCi), cerca de 10 ng. Um grama de 210 Po poderia, assim, em teoria veneno 20 milhões de pessoas, das quais 10 milhões morreriam. A toxicidade real de 210 Po é menor do que as estimativas, porque a exposição à radiação que é distribuída ao longo de várias semanas (o meia-vida biológica de polônio em seres humanos é de 30 a 50 dias) é um pouco menos prejudicial do que uma dose instantânea. Estimou-se que uma dose letal média de 210 Po é 0,015 GBq (0,4 mCi), ou 0,089 microgramas, ainda uma quantidade extremamente pequena.
Longo prazo efeitos (crónica)
Em adição aos efeitos agudos, a exposição à radiação (tanto interna como externa) transporta um risco a longo prazo de morte por cancro de 5-10% por Sv. A população em geral está exposta a pequenas quantidades de polônio como radônio filha no ar interior; os isótopos 214 Po e 218 Po são pensados para causar a maioria dos cerca de 15,000-22,000 mortes por câncer de pulmão em os EUA a cada ano que têm sido atribuídos ao radão interior. O fumo de tabaco provoca a exposição adicional ao polônio.
Limites regulamentares de exposição e manipulação
A carga corporal máximo permitido para ingerido 210 Po é de apenas 1,1 kBq (30 NCI), o que equivale a uma partícula concentrando apenas 6,8 picogramas. A concentração local de trabalho máxima admissível no ar de 210 Po é de cerca de 10 Bq / m 3 (3 × 10 -10 uCi / cm 3). Os órgãos-alvo para polônio em humanos são o e baço fígado. Como o baço (150 g) e o fígado (1,3-3 kg), são muito menores do que no resto do corpo, se o polônio é concentrada nestes órgãos vitais, que é uma grande ameaça para a vida do que a dose que seria sofrido (em média) por todo o corpo, se foram distribuídos uniformemente por todo o corpo, da mesma forma como césio ou trítio (como T 2 O).
210 Po é amplamente utilizado na indústria, e prontamente disponíveis com pouca regulamentação ou restrição. Em os EUA, um sistema de rastreamento gerido pela Comissão Reguladora Nuclear será implementado em 2007 para registrar as compras de mais de 16 curies (590 GBq) de polônio-210 (o suficiente para tornar-se 5000 doses letais). A AIEA "está a ser dito considerando regulamentos mais apertados ... Fala-se que poderia apertar a obrigação de apresentar relatórios polônio por um fator de 10, para 1,6 curies (59 GBq)."
Polônio e seus compostos devem ser tratados de uma caixa de luva, que é posteriormente fechada na outra caixa, mantida a uma pressão ligeiramente menor do que o porta-luvas para evitar que os materiais radioactivos de vazar para fora. Luvas de madeira natural de borracha não oferecem proteção suficiente contra a radiação do polônio; luvas cirúrgicas são necessárias. Luvas de neoprene proteger a radiação de polônio melhor do que a borracha natural.
Bem conhecido casos de intoxicação
Notavelmente, o assassinato de Alexander Litvinenko, um dissidente russo, em 2006, foi anunciado como devido a envenenamento por 210 Po (veja Envenenamento por Alexander Litvinenko). De acordo com o Prof. Nick Priest de Middlesex University, uma toxicologista ambiental e especialista em radiação, falando em Sky News em 2 de dezembro, Litvinenko foi provavelmente a primeira pessoa a morrer da efeitos de radiação α-agudos de 210 Po. No entanto, de acordo com William Dunkerley, pesquisador sênior da Universidade Americana em Moscou, o legista de Londres ainda tem que determinar que o polônio foi realmente a causa da morte de Litvinenko, ou que ele era mesmo uma vítima de homicídio.
Também tem sido sugerido que Irène Joliot-Curie foi a primeira pessoa a morrer vítima dos efeitos de radiação do polônio. Ela foi acidentalmente exposto ao polônio em 1946, quando uma cápsula selada do elemento explodiu em sua bancada de laboratório. Em 1956 ela morreu de leucemia.
De acordo com o livro a bomba no porão, vários casos de morte em Israel durante 1957-1969 foram causados por 210 Po. Um vazamento foi descoberto em um Laboratório do Instituto Weizmann, em 1957. Traços de 210 Po foram encontrados nas mãos do professor Dror Sadeh, um físico que pesquisou materiais radioativos. Exames médicos indicaram nenhum dano, mas os testes não incluem medula óssea. Sadeh morreu de câncer . Um de seus alunos morreram de leucemia, e dois colegas morreram depois de alguns anos, ambos de câncer. A questão foi investigada em segredo, e nunca houve qualquer admissão formal de que uma ligação entre o vazamento e as mortes tivessem existido.
Anormalmente altas concentrações de 210 Po foram detectados em julho de 2012, em roupas e pertences pessoais do líder palestino Yasser Arafat, que morreu em 2004 de causas incertas. No entanto, o porta-voz do Institut de Radiophysique em Lausanne, na Suíça, onde foram analisados os itens, destacou que os "sintomas clínicos descritos em relatórios médicos de Arafat não eram consistentes com polônio-210 e que as conclusões não podiam ser tiradas sobre se a Palestina líder foi envenenado ou não ", e que" a única forma de confirmar os achados seria exumar o corpo de Arafat para testá-lo por polônio-210. " Em 27 de novembro de 2012 o corpo de Arafat foi exumado e foram retiradas amostras para análise separada por especialistas da França, Suíça e Rússia. Os resultados são esperados até abril de 2013.
Tratamento
Tem sido sugerido que agentes de quelação tais como a British Anti-Lewisite ( dimercaprol) pode ser usado para descontaminar os seres humanos. Numa experiência, os ratos receberam uma dose fatal de 1,45 MBq / kg (8,7 ng / kg) de 210 Po; Todos os ratos não tratados foram mortos após 44 dias, mas 90% dos ratos tratados com o agente de quelação HOEtTTC permaneceram vivos após 5 meses.
Detecção em amostras biológicas
O polônio-210 pode ser quantificada em espécimes biológicos por espectrometria de partículas para confirmar um diagnóstico de envenenamento em pacientes hospitalizados ou para fornecer provas em uma investigação médico-legal da morte. A excreção urinária de linha de base de polônio-210 em pessoas saudáveis, devido à exposição a fontes ambientais de rotina é normalmente numa gama de 5-15 MBq / dia. Níveis em excesso de 30 MBq / dia são sugestivos de uma exposição excessiva ao radionuclídeo.
Os produtos comerciais contendo polônio
Algumas escovas anti-estáticos conter até 500 microcuries (20 MBq) de 210 Po como uma fonte de partículas carregadas para neutralizar a electricidade estática. Nos EUA, os dispositivos com não mais do que 500 Ci de (selado) 210 Po por unidade pode ser comprado em qualquer quantidade sob uma "licença geral", o que significa que um comprador não precisa ser registrado por qualquer autoridade.
Pequenas quantidades de tais radioisótopos são por vezes usados em laboratório e para fins de ensino tipicamente da ordem de 4-40 kBq (0,1-1,0 uCi), sob a forma de fontes seladas, com o polônio depositada sobre um substrato ou numa resina ou polímero matriz são muitas vezes isentos de licenciamento pelo NRC e autoridades semelhantes como eles não são considerados perigosos. Pequenas quantidades de 210 Po são fabricados para venda ao público nos Estados Unidos como "fontes de agulha" para experimentação em laboratório, e são distribuídos por empresas de fornecimento científicos. O polônio real é uma camada de metalização que por sua vez é revestida com um material tal como o ouro. Isto permite que o radiação alfa (utilizados em experiências, como as câmaras de nuvem), impedindo o polônio sejam libertados e que apresentam um risco tóxico. Conforme United Nuclear, eles normalmente vendem entre quatro e oito fontes por ano.
Ocorrência em seres humanos ea biosfera
O polônio-210 é generalizada na biosfera , incluindo em tecidos humanos, por causa de sua posição no urânio-238 cadeia de decaimento. Natural urânio-238 na crosta terrestre decai através de uma série de intermediários radioactivos sólidos incluindo rádio-226 para o gás radioactivo radão-222, alguns dos quais, durante o seu 3,6-dia meia-vida, difunde-se para a atmosfera. Não se decompõe através de vários passos mais para polônio-210, muitos dos quais, durante a sua meia-vida de 138 dias, é lavado de volta para a superfície da Terra, entrando, assim, a biosfera, antes de finalmente decadente para estável levar-206.
Quanto mais cedo a Lacassagne década de 1920, usando polônio fornecida por seu colega Marie Curie , mostrou que o elemento tem um padrão muito específico de captação nos tecidos de coelho, com altas concentrações particularmente em fígado, rim e testículos. Evidências mais recentes sugerem que esse comportamento resulta de polônio substituindo enxofre em aminoácidos contendo enxofre ou moléculas relacionadas e que padrões semelhantes de distribuição ocorrem em tecidos humanos. O polônio é de fato um elemento naturalmente presente em todos os seres humanos, contribuindo sensivelmente para dose de fundo natural, com grandes variações geográficas e culturais e níveis particularmente altos em moradores do Ártico, por exemplo.
Tabaco
A presença de polônio na fumaça do tabaco tem sido conhecida desde o início da década de 1960. Algumas das maiores empresas de tabaco do mundo pesquisado maneiras para remover a substância-sem sucesso-ao longo de um período de 40 anos, mas nunca publicou os resultados.
Radioativo polônio-210 contido nos adubos de fosfato é absorvida pelas raízes das plantas (tais como tabaco) e armazenados nos seus tecidos. As plantas de tabaco fertilizados por fosfatos de rocha contêm polônio-210, que emite radiação alfa estimada em causa cerca de 11.700 mortes por câncer de pulmão por ano em todo o mundo.
Comida
O polônio também é encontrado na cadeia alimentar, especialmente em frutos do mar.
