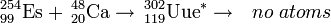Einsteinium
Você sabia ...
Crianças SOS, que corre cerca de 200 sos escolas no mundo em desenvolvimento, organizado esta selecção. Clique aqui para saber mais sobre apadrinhamento de crianças.
| Einsteinium | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
99 Es | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | ||||||||||||||||||||||||||||||||||||||||||||||||||||
prateado 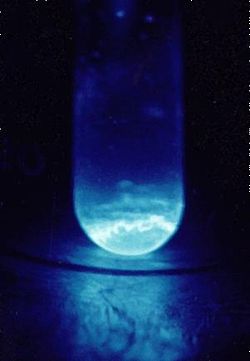 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | einsteinium, Es, 99 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / aɪ n s t aɪ n Eu ə m / STY eyen- -nee-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria Metallic | actinide | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | n / D, 7, f | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | (252) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Rn ] 5f 11 7s 2 2, 8, 18, 32, 29, 8, 2 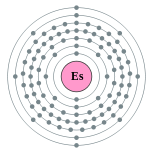 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| História | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descoberta | Lawrence Berkeley National Laboratory (1952) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 8,84 g cm -3 · | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 1,133 K , 860 ° C, 1580 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 2, 3, 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 1,3 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização | 1º: 619 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | cúbica de face centrada  | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | paramagnético | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7429-92-7 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de einsteinium | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
Einsteinium é um elemento sintético com o símbolo Es e número atômico 99. É o sétimo elemento transuranic, e um actinide .
Einsteinium foi descoberto como um componente de os detritos da primeira explosão de uma bomba de hidrogênio em 1952, e nomeado após Albert Einstein . Sua mais comum isótopo einstênio-253 (meia-vida 20,47 dias) é produzido artificialmente a partir de decaimento do califórnio-253 em alguns de alta potência dedicado reactores nucleares com um rendimento total na ordem de um miligrama por ano. A síntese do reactor é seguido por um procedimento complexo de separar einsteinium-253 a partir de outras actinídeos e produtos da sua decomposição. Outros isótopos são sintetizadas em vários laboratórios, mas por valores muito menores, bombardeando elementos actinídeos pesados com íons leves. Devido às pequenas quantidades de einsteinium produzido ea meia-vida curta de seu isótopo mais facilmente produzido, há atualmente quase não há aplicações práticas para ele fora da pesquisa científica básica. Em particular, einsteinium foi utilizado para sintetizar, pela primeira vez, 17 átomos de novo o elemento mendelevium em 1955.
Einsteinium é um macio, prateado, paramagnética de metal . A sua química é típica do final dos actinídeos, com uma preponderância de 3 a estado de oxidação ; o estado de oxidação +2, também é acessível, especialmente em sólidos. A alta radioatividade de einsteinium-253 produz um brilho visível e rapidamente danos a sua estrutura cristalina do metal, com calor lançado de cerca de 1000 watts por grama. Dificuldade em estudar suas propriedades é devido a einsteinium-253 para a conversão de berquélio e depois califórnio a uma taxa de cerca de 3% por dia. O isótopo de einsteinium com a mais longa meia vida, einsteinium-252 (semi-vida de 471,7 dias) seria mais apropriada para a investigação de propriedades físicas, mas provou ser muito mais difícil de produzir e está disponível apenas em quantidades mínimas, e não em grandes quantidades . Einsteinium é o elemento com o maior número atômico que tem sido observado em quantidades macroscópicas em sua forma pura, e este foi o comum isótopo de curta duração einsteinium-253.
Como todos sintética elementos transurânicos, isótopos de einsteinium são extremamente radioactivos e são considerados altamente perigosos para a saúde na ingestão.
História


Einsteinium foi identificado pela primeira vez em Dezembro de 1952 por Albert Ghiorso e colegas de trabalho no University of California, Berkeley em colaboração com o Argonne e Los Alamos National Laboratories, na precipitação da Ivy Mike teste nuclear. O teste foi realizado em 01 de novembro de 1952 no Enewetak no Oceano Pacífico e foi o primeiro teste bem sucedido de um bomba de hidrogênio. O exame inicial dos escombros da explosão havia mostrado a produção de um novo isótopo de plutônio , 244
94 Pu, o que só poderia ter formado pela absorção de seis nêutrons por um urânio-238 núcleo seguido por dois decaimentos beta.
No momento, a absorção de neutrões múltipla foi pensado para ser um processo extremamente raro, mas a identificação de 244
94 Pu indicou que ainda mais nêutrons poderia ter sido capturado pelos núcleos de urânio, produzindo, assim, novos elementos mais pesados que o califórnio .
Ghiorso e colaboradores analisaram papéis de filtro, que tinha sido percorridos através da nuvem de explosão em aviões (a mesma técnica de amostragem que tinha sido utilizado para descobrir 244
94 Pu). Grandes quantidades de material radioactivo foram posteriormente isolados a partir de restos de coral do atol, que foram entregues para os EUA A separação dos novos elementos suspeitos foi realizada na presença de um ácido cítrico / amônio solução tampão num meio fracamente acídico ( pH ≈ 3,5), usando de permuta iónica, a temperaturas elevadas; menos de 200 átomos de einsteinium foram recuperados no final. No entanto, elemento 99 (einsteinium), nomeadamente o seu isótopo 253 Es, poderia ser detectado através de sua característica de alta energia decaimento alfa em 6,6 MeV. Foi produzido pela captura de 15 neutrões por urânio 238 núcleos seguido por sete beta-decaimentos, e tinha uma meia-vida de 20,5 dias. Essa absorção de nêutrons múltipla foi possível graças a densidade de fluxo elevado de nêutrons durante a detonação, de modo que os isótopos pesados recém-gerados tinha muito de nêutrons disponíveis para absorver antes que eles pudessem desintegrar-se em elementos mais leves. Captura de neutrões inicialmente levantou a número de massa, sem alterar o número atómico do nuclídeo, e as concomitantes beta-decaimentos resultou em um aumento gradual no número atómico:
Alguns 238 U átomos, no entanto, pode absorver mais dois neutrões (para um total de 17), resultando em 255 Es, bem como na 255 Fm isótopo de um novo elemento, fermium . A descoberta dos novos elementos e os novos dados associados em vários captura de nêutrons foram inicialmente mantidos em segredo sob as ordens do exército dos EUA até 1955, devido à Guerra Fria tensões e competição com União Soviética em tecnologias nucleares. No entanto, a rápida captura de neutrões tantas proporcionaria confirmação experimental direta necessária da chamada r-processo de absorção de nêutrons múltipla necessária para explicar o cósmico nucleossíntese (de produção) de certos elementos químicos pesados (mais pesados que o níquel) em supernovas explosões, antes decaimento beta. Tal processo é necessária para explicar a existência de muitos elementos estáveis no universo.
Enquanto isso, os isótopos de elemento 99 (assim como de novo elemento 100, fermium ) foram produzidos nos laboratórios Berkeley e Argonne, numa reação nuclear entre azoto -14 e urânio-238, e mais tarde por irradiação de neutrões intenso de plutónio ou califórnio :
Estes resultados foram publicados em vários artigos em 1954, com o aviso de que estes não foram os primeiros estudos que foram realizados sobre os elementos. A equipe de Berkeley também relataram alguns resultados sobre as propriedades químicas de einsteinium e fermium. Os resultados Ivy Mike foram desclassificados e publicados em 1955.
Em sua descoberta dos elementos 99 e 100, as equipes americanas tinham competido com um grupo no Instituto Nobel de Física, Estocolmo , Suécia . No final de 1953 - início de 1954, o grupo sueco conseguido a síntese de isótopos de luz de elemento 100, em particular 250 Fm, bombardeando o urânio com núcleos de oxigénio. Estes resultados também foram publicados em 1954. No entanto, a prioridade da equipe de Berkeley era geralmente reconhecido, como suas publicações precedeu o artigo sueco, e eles tiveram por base os resultados previamente reservadas das 1952 explosão termonuclear; assim, a equipe de Berkeley foi dado o privilégio de nomear os novos elementos. Dado que o esforço que levou à concepção de Ivy Mike recebeu o codinome Projeto PANDA, elemento 99 tinham sido jocosamente apelidado de "Pandamonium", mas os nomes oficiais sugerido pelo grupo de Berkeley derivado de dois cientistas proeminentes e recentemente falecidos, Albert Einstein (falecido em 18 de abril 1955) e Enrico Fermi (falecido em 28 de novembro de 1954): "Nós sugerimos para o nome para o elemento com o número atômico 99, einsteinium (símbolo E) depois de Albert Einstein e para o nome para o elemento com número atômico 100, fermium (símbolo Fm), depois de Enrico Fermi. " A descoberta destes novos elementos foi anunciada pelo Albert Ghiorso na primeira Conferência Atomic Genebra realizada em 08-20 agosto de 1955. O símbolo para einsteinium foi primeiro dada como E e mais tarde re-atribuído a Es.
Características
Físico

Einsteinium é um sintética, branco-prateado, metal radioativo. Na tabela periódica , que está localizado à direita da actinídeos californium , à esquerda do actinídeos fermium e abaixo do lantanídeo hólmio com a qual partilha muitas similaridades nas propriedades físicas e químicas. A sua densidade de 8,84 g / cm 3 é menor do que a de californium (15,1 g / cm3) e é quase a mesma que a de hólmio (8,79 g / cm 3), apesar einsteinium atómica sendo muito mais pesado do que o hólmio. O ponto de einsteinium (860 ° C) de fusão também é relativamente baixa - abaixo californium (900 ° C), fermium (1527 ° C) e hólmio (1461 ° C). Einsteinium é um metal macio, com a módulo de volume de apenas 15 GPa, cujo valor é um dos mais baixos entre os não- metais alcalinos .
Ao contrário do que os mais leves actinides califórnio, berkelium, cúrio e amerício que cristalizam em um duplo estrutura hexagonal em condições ambiente, einsteinium se acredita ter um cúbico (FCC) simetria de face centrada com o grupo espacial Fm 3 m e a estrutura uma constante = 575 pm. No entanto, existe um relatório de temperatura ambiente einsteinium hexagonal de metal com a = 398 pm e 650 pm = c, que convertida para a fase de FCC após aquecimento a 300 ° C.
A auto-danos induzidos pela radioactividade de einsteinium é tão forte que destrói rápida da rede cristalina, e a libertação de energia durante este processo, 1.000 watts por grama de 253 Es, induz um brilho visível. Estes processos podem contribuir para a densidade e o ponto de fusão relativamente baixo einsteinium. Além disso, devido ao pequeno tamanho das amostras disponíveis, o ponto de fusão foi einsteinium frequentemente deduzida por observação da amostra a ser aquecido dentro de um microscópio electrónico. Assim, os efeitos de superfície em amostras pequenas poderá reduzir o valor do ponto de fusão.
O metal é divalente e tem uma volatilidade notavelmente alta. A fim de reduzir os danos auto-radiação, a maioria das medições de einsteinium sólido e os seus compostos são realizadas logo após o tratamento térmico. Além disso, alguns compostos são estudados sob a atmosfera de gás redutor, por exemplo H 2 O + HCl durante EsOCl modo que a amostra é parcialmente crescido durante a sua decomposição.
Além da auto-destruição de einsteinium sólida e seus compostos, outras dificuldades intrínsecas em estudar este elemento incluem escassez - o mais comum 253 Es isótopo está disponível apenas uma vez ou duas vezes por ano em quantidades sub-miligrama - e auto-contaminação devido ao rápido conversão de einsteinium para berquélio e depois para califórnio a uma taxa de cerca de 3,3% por dia:
Assim, a maioria das amostras einsteinio estão contaminados, e suas propriedades intrínsecas são muitas vezes deduzida por extrapolação de volta dados experimentais acumulados ao longo do tempo. Outras técnicas experimentais para contornar o problema de contaminação incluem excitação óptica selectiva de iões einsteinium por um laser sintonizável, tal como no estudo das suas propriedades de luminescência.
Propriedades magnéticas foram estudadas para einsteinium metal, o seu óxido e flúor. Todos os três materiais mostraram Curie-Weiss comportamento paramagnética de hélio líquido à temperatura ambiente. Os momentos magnéticos efetivos foram deduzidas como 10,4 ± 0,3 μ B para Es 2 O 3 e 11,4 ± 0,3 μ B para o FSE 3, que são os valores mais elevados actinides, eo correspondente Temperaturas Curie são 53 e 37 K.
Químico
Como todos os actinídeos, einsteinium é bastante reativo. Sua trivalente estado de oxidação é mais estável em sólidos e solução aquosa onde induzidas cor rosa pálido. A existência de bivalente einsteinium está firmemente estabelecida, especialmente na fase sólida; tais +2 estado não é observado em muitos outros actinides, incluindo protactinium , urânio , neptunium , plutônio, cúrio e berquélio. Einsteinium (II) compostos podem ser obtidos, por exemplo, através da redução einsteinium (III) com samário (II), cloreto. O estado de oxidação +4 foi postulada a partir de estudos de vapor e é ainda incerto.
Isótopos
Dezenove nuclides e três isómeros nucleares são conhecidos por einsteinium com pesos atómicos que variam de 240 a 258. Todos são radioactivos e o nuclídeo mais estável, 252 Es, tem uma meia-vida de 471,7 dias. Próximo isótopos mais estáveis são 254 Es (meia-vida 275,7 dias), 255 Es (39,8 dias) e 253 Es (20,47 dias). Todos os isótopos restantes têm meias-vidas mais curtas do que 40 horas, e a maioria deles deterioração num período inferior a 30 minutos. Dos três isómeros nucleares, o mais estável é de 254 m Es com meia-vida de 39,3 horas.
Fissão nuclear
Einsteinium tem uma alta taxa de fissão nuclear que resulta num baixo massa crítica para uma sustentada reação nuclear em cadeia. Esta massa é 9,89 kg para uma esfera de 254 nua Es isótopo, e pode ser reduzido para 2,9 ou mesmo 2,26 kg, respectivamente, por adição de um aço de espessura 30 centímetros ou reflector de água. No entanto, mesmo essa pequena massa crítica excede em muito a quantidade total de einsteinium isolado, até agora, especialmente do raro isótopo 254 Es.
Ocorrência natural
Devido à curta semi-vida de todos os isótopos de einsteinium, todos einsteinium primordial, que é einsteinium que poderia estar presente na Terra durante a sua formação, decaiu até agora. Síntese de einsteinium ocorra naturalmente actinides urânio e tório na crosta da Terra requer captura de nêutrons múltipla, que é um evento extremamente improvável. Portanto, a maioria einsteinium é produzido na Terra em laboratórios científicos, de alta potência, reatores nucleares, ou em testes de armas nucleares, e está presente apenas dentro de poucos anos a partir do momento da síntese. Einsteinium e fermium fez ocorrem naturalmente no reator de fissão nuclear natural em Oklo, mas não mais fazê-lo.
Síntese e extracção
Einsteinium é produzido em quantidades mínimas bombardeando actinides mais leves com nêutrons em dedicado de alto fluxo reatores nucleares. Principais fontes de irradiação do mundo estão a 85 megawatts alta Flux Isotope Reactor (HFIR) no Oak Ridge National Laboratory, no Tennessee, EUA, eo reactor SM-2 laço na Instituto de Pesquisa de reatores atômicos (NIIAR) em Dimitrovgrad, Rússia, ambos os quais são dedicados à produção de transcurium (Z> 96) elementos. Estas instalações têm poder e os níveis de fluxo semelhantes, e deverão ter capacidade de produção comparáveis para elementos transcurium, embora as quantidades produzidas em NIIAR não são amplamente relatados. Em uma "campanha de processamento típica" em Oak Ridge, dezenas de gramas de cúrio são irradiados para produzir quantidades decigrama de califórnio , quantidades de miligramas de berquélio (Bk 249) e einsteinio e picogramas quantidades de fermium .
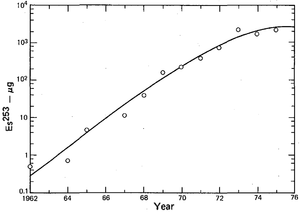
A primeira amostra microscópico de 253 Es amostra pesando cerca de 10 nanogramas foi preparado em 1961 pelo HFIR. Um equilíbrio magnético especial foi desenvolvido para estimar seu peso. Lotes maiores foram produzidos mais tarde a partir de vários quilos de plutônio com os rendimentos einsteinio (principalmente 253 Es) de 0,48 miligramas em 1967-1970, 3,2 miligramas em 1971-1973, seguido de produção estável de cerca de 3 miligramas por ano entre 1974 e 1978. Essas quantidades no entanto referir-se ao montante integral no alvo certo após a irradiação. Procedimentos de separação subsequentes reduziu a quantidade de einsteinium isotopicamente puro aproximadamente dez vezes.
Síntese Laboratório
Irradiação de nêutrons pesado de resultados de plutônio em quatro grandes isótopos de einsteinium: 253 Es (α-emissor com meia-vida de 20,03 dias e com uma meia-vida de fissão espontânea de 7 × 10 5 anos); 254 m Es (β-emissor com meia-vida de 38,5 horas), 254 Es (α-emissor com uma semi-vida de cerca de 276 dias) e 255 (Es β-emissor com uma meia-vida de 24 dias). Uma via alternativa envolve bombardeio de urânio-238 com nitrogênio ou de íons de oxigênio feixes de alta intensidade.
Einsteinium-247 (meia-vida 4,55 minutos) foi produzido por irradiação amerício-241 com carvão ou urânio-238 com íons de nitrogênio. A última reacção foi realizada pela primeira vez em 1967, em Dubna, Rússia, e os cientistas envolvidos foram agraciados com o Prêmio Lenin Komsomol.
O isótopo 248 Es foi produzido por irradiação 249 Cf com íons de deutério. É principalmente decai por emissão de electrões a 248 Cf com uma meia-vida de 25 (± 5) minutos, mas liberta também α-partículas de 6,87 MeV de energia, com a proporção de electrões para α-partículas de cerca de 400.
Os isótopos mais pesados 249 250 ES, ES, 251 e 252 Es Es foram obtidos bombardeando 249 Bk com α-partículas. Um a quatro neutrões são libertadas neste processo tornando possível a formação de quatro isótopos diferentes em uma reacção.
Einsteinium-253 foi produzido por irradiação um alvo 252 Cf 0,1-0,2 miligramas com um fluxo de nêutrons térmicos de (2-5) × 10 14 nêutrons · cm -2 · s -1 para 500-900 horas:
Síntese em explosões nucleares
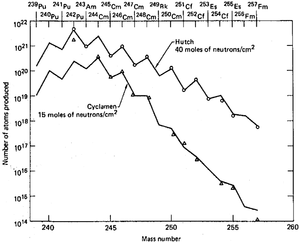
A análise dos detritos no 10- megaton Ivy Mike teste nuclear foi uma parte do projeto a longo prazo. Um dos objetivos dos quais estava estudando a eficiência da produção de elementos transuranianos em alta potência explosões nucleares. A motivação para estas experiências era que a síntese de tais elementos de urânio requer múltiplos captura de nêutrons. A probabilidade de tais eventos aumenta com o fluxo de nêutrons, e explosões nucleares são as mais poderosas fontes de neutrões feitas pelo homem, oferecendo densidades da ordem de 10 23 nêutrons / cm² dentro de um microssegundo, ou cerca de 10 nêutrons 29 / (cm² · s). Em comparação, o fluxo do reactor é HFIR 5 × 10 15 neutrões / (cm · s). Um laboratório dedicado foi criado à direita na Enewetak para análise preliminar de detritos, como alguns isótopos poderia ter deteriorado pelo tempo que as amostras de detritos atingiu o continente norte-americano O laboratório estava recebendo amostras para análise, logo que possível, a partir de aviões equipados com filtros de papel que voou sobre o atol depois dos testes . Considerando que se esperava descobrir novos elementos químicos mais pesados que fermium, nenhum destes foram encontradas mesmo após uma série de explosões megaton realizado entre 1954 e 1956 no atol.
Os resultados atmosféricas foram complementados pelos dados de teste subterrâneas acumuladas na década de 1960 no Nevada Test Site, como esperava-se que as explosões poderosas realizadas em espaço confinado pode resultar em melhores rendimentos e isótopos mais pesados. Além de encargos tradicionais de urânio, combinações de urânio com amerício e tório têm sido experimentadas, bem como uma taxa de plutônio-neptunium misto, mas eles foram menos bem sucedidos em termos de rendimento e foi atribuída a perdas mais fortes de isótopos pesados devido às taxas de fissão reforçada em encargos pesados de elementos. O isolamento do produto era problemático como as explosões foram se espalhando detritos através de fusão e vaporização as rochas circundantes em profundidades de 300-600 metros. Perfurando a tais profundidades para extrair os produtos foi tanto lento e ineficiente em termos de volumes recolhidos.
Entre os nove testes subterrâneos que foram realizadas entre 1962 e 1969, o último foi o mais poderoso e teve o maior rendimento de elementos transuranianos. Miligramas de einsteinium que normalmente levariam um ano de irradiação em um reator de alta potência, foram produzidos dentro de um microssegundo. No entanto, o grande problema prático de toda a proposta foi recolhendo os detritos radioactivos dispersos pela poderosa explosão. Filtros de aeronaves adsorvido apenas cerca de 4 × 10 -14 do total, e recolha de toneladas de corais na enewetak aumentou esta fracção por apenas duas ordens de magnitude. Extracção de cerca de 500 quilogramas de rochas subterrâneas 60 dias após a explosão Hutch recuperados apenas cerca de 1 x 10 -7 da carga total. A quantidade de elementos transurânicos neste lote de 500 kg era apenas 30 vezes maior do que 0,4 kg de uma rocha pegou 7 dias após o teste que demonstrou a dependência altamente não-linear do rendimento de elementos transurânicos na quantidade de rocha radioactiva recuperada. Eixos foram perfurados no local antes do teste, a fim de acelerar a coleta de amostra após a explosão, de modo que explosão iria expelir material radioativo do epicentro através dos poços e da coleta de volumes perto da superfície. Este método foi julgado em dois testes e desde instantaneamente centenas de quilos de material, mas com concentração actinide 3 vezes menor do que em amostras obtidas após a perfuração. Considerando que tal método poderia ter sido eficiente em estudos científicos de isótopos de vida curta, não poderia melhorar a eficiência de coleta global dos actinídeos produzidos.
Embora não há novos elementos (além de einsteinium e fermium) pôde ser detectado nos escombros teste nuclear, e os rendimentos totais dos elementos transuranianos eram decepcionantemente baixo, estes testes não forneceu valores significativamente mais elevados de isótopos pesados raras do que anteriormente disponível em laboratórios.
Separação
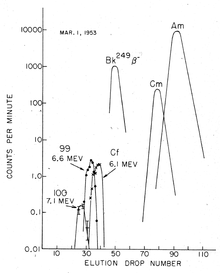
Processo de separação de einsteinium depende do método de síntese. No caso do bombardeamento de iões de luz no interior de um ciclotrão, o alvo de iões pesados é ligado a uma folha fina, e a einsteinium gerado é simplesmente lavada fora da folha após a irradiação. No entanto, as quantidades produzidas em tais experiências são relativamente baixos. Os rendimentos são muito maiores em termos de irradiação do reactor, mas existe, o produto é uma mistura de vários isótopos de actinídeos, bem como lantanídeos produzidos na cisão nuclear decai. Neste caso, o isolamento de einsteinium é um procedimento tedioso que envolve vários passos de repetição de permuta catiónica, a uma temperatura e pressão elevada, e cromatografia. Separação de berquélio é importante, porque o isótopo einstênio mais comum produzido em reatores nucleares, 253 Es, decai com uma meia-vida de apenas 20 dias para 249 Bk, que é rápido na escala de tempo da maioria dos experimentos. Esta separação baseia-se no fato de que berquélio facilmente oxida ao sólido 4 Estado e precipita, enquanto outros actinides, incluindo einsteinium, permanecem em seu estado +3 em soluções.
Separação dos actinídeos trivalentes de produtos de fissão lantanídeo pode ser feito por uma coluna de resina de permuta catiónica utilizando uma solução de etanol 90% de água / 10% saturado com ácido clorídrico (HCl) como eluente. É geralmente seguida de cromatografia de permuta aniónica utilizando 6 HCl molar como eluente. Uma coluna de resina de permuta catiónica (Dowex-50 coluna de permuta) tratada com sais de amónio é, em seguida, utilizado para separar as fracções que contêm elementos 99, 100 e 101. Estes elementos podem ser então identificados simplesmente com base na sua posição de eluição / hora, utilizando-α hydroxyisobutyrate solução (α-HIB), por exemplo, como eluente.
A separação dos actinídeos 3+ também pode ser conseguida por cromatografia de extracção com solvente, usando bis- (2-etilhexil) do ácido fosfórico (abreviado como HDEHP) como a fase orgânica estacionário, e ácido nítrico como a fase móvel aquosa. A sequência dos actinídeos de eluição é invertido a partir do que a coluna de resina de permuta catiónica. O einsteinium separadas por este método tem a vantagem de ser livre de agente de complexação orgânico, em comparação com a separação utilizando uma coluna de resina.
Preparação do metal
Einsteinium é altamente reactiva e, por conseguinte, agentes redutores fortes são necessários para obter o metal puro a partir dos seus compostos. Isto pode ser conseguido através da redução de einsteinium fluoreto de (III) com metálico lítio :
- EsF 3 + 3 Li → ES + 3 LiF
No entanto, devido ao seu baixo ponto de fusão e elevada taxa de danos auto-radiação, einsteinium tem alta pressão de vapor, o qual é maior do que a de fluoreto de lítio. Isso faz com que esta reacção de redução bastante ineficiente. Ele foi julgado nas tentativas iniciais de preparação e rapidamente abandonada em favor da redução da einsteinium (III) óxido com lantânio do metal:
- Es 2 O 3 + 2 La → ES + La 2 O 3
Os compostos químicos
| Composto | Cor | Simetria | Grupo espacial | Não | Símbolo Pearson | um ( pm) | b (pm) | c (h) |
|---|---|---|---|---|---|---|---|---|
| Es 2 O 3 | Incolor | Cúbico | Ia 3 | 206 | cI80 | 1.076,6 | ||
| Es 2 O 3 | Incolor | Monoclinic | C2 / m | 12 | MS30 | 1411 | 359 | 880 |
| Es 2 O 3 | Incolor | Hexagonal | P 3 M1 | 164 | hP5 | 370 | 600 | |
| EsF 3 | Hexagonal | |||||||
| EsF 4 | Monoclinic | C2 / c | 15 | MS60 | ||||
| ESCL 3 | Laranja | Hexagonal | C6 3 / m | HP8 | 727 | 410 | ||
| ESBR 3 | Amarelo | Monoclinic | C2 / m | 12 | MS16 | 727 | 1259 | 681 |
| ESI 3 | Âmbar | Hexagonal | R3 | 148 | hR24 | 753 | 2084 | |
| EsOCl | Tetragonal | P4 / NMM | 394.8 | 670,2 |
Óxidos
Einsteinium (III) óxido (Es 2 O 3) foi obtido por einsteinium (III), nitrato de queima. Forma cristais cúbicos incolores, que foram caracterizadas primeiro a partir de amostras microgramas dimensionado cerca de 30 nanômetros. Duas outras fases, monoclínico e hexagonais, são conhecidos para este óxido. A formação de uma certa fase de Es 2 O 3 depende da história da técnica de preparação da amostra e, e não há diagrama de fase clara. Interconversões entre as três fases pode ocorrer espontaneamente, como resultado da auto-irradiação ou auto-aquecimento. A fase hexagonal é com isotípico de lantânio (III) óxido, onde os iões de Es 3+ está rodeado por um grupo 6-O 2- coordenada de iões.
Halides
Einsteinium halogenetos são conhecidos para os estados de oxidação +2 e +3. O estado mais estável é +3 para todos os halogenetos de fluoreto de iodeto.
Einsteinium (III), fluoreto (FSE 3) pode ser precipitado a partir einsteinium (III) soluções de cloreto por reacção com íons de flúor. Um processo de preparação alternativo é einsteinium exposição (III), óxido de trifluoreto de cloro (ClF 3) 2 ou F de gás a uma pressão de 1-2 atmosferas e a uma temperatura entre 300 e 400 ° C. A estrutura cristalina EsF 3 é hexagonal, como em califórnio (III) flúor (CFF 3) onde os íons do Es 3+ são 8 vezes coordenados por íons de flúor em um bicapped arranjo prisma trigonal.
Einsteinium cloreto de (III) (ESCL 3) pode ser preparado por emparelhamento einsteinium (III) óxido, em atmosfera de vapores de cloreto de hidrogénio seco a cerca de 500 ° C durante cerca de 20 minutos. Cristaliza-se depois do arrefecimento a cerca de 425 ° C na forma de um sólido laranja com um estrutura hexagonal de Tipo UCl3, onde os átomos einsteinio são 9 vezes em coordenado por átomos de cloro em uma geometria prisma trigonal tricapped. Einsteinium (III) brometo (ESBR 3) é um sólido amarelo pálido com um estrutura monoclínica de AlCl3 tipo , onde os átomos são einsteinio octaedricamente coordenado por bromo (número de coordenação 6).
Os compostos divalentes de einsteinium são obtidos através da redução dos halogenetos trivalentes com hidrogénio :
- 2 ESX 3 + H 2 2 → ESX 2 + 2 HX, X = F, Cl, Br, I
Einsteinium (II) cloreto (ESCL 2), einsteinium (II) brometo (ESBR 2), e einsteinium (II) iodeto (ESI 2) foram produzidos e caracterizados por absorção óptica, com nenhuma informação estrutural disponível ainda.
Oxihaletos conhecidos de einsteinium incluem EsOCl, EsOBr e EsOI. Eles são sintetizados por tratamento de um tri-halogeneto com uma mistura de vapor de água e do halogeneto de hidrogénio correspondentes: por exemplo, ESCL 3 + H 2 O / HCl para se obter EsOCl.
Compostos Organoeinsteinium
A alta radioatividade de einsteinium tem um uso potencial em terapia de radiação, e complexos organometálicos foram sintetizados a fim de proporcionar átomos einsteinium a um órgão adequado no corpo. Os experimentos foram realizados em injetar einsteinium citrato (bem como os compostos fermium) para cães. Einsteinium (III) foi também incorporada no beta-dicetona quelatos, desde complexos análogos com lantanídeos anteriormente mostrou mais forte UV-animado luminescência entre os compostos metalorgânicos. Ao preparar einsteinio complexos, os íons Es 3+ foram 1000 vezes diluído com íons Gd 3 +. Isto permitiu reduzir o dano de radiação de modo a que os compostos não se desintegraram durante o período de 20 minutos necessários para as medições. A luminescência resultante do Es 3+ foi muito fraco demais para ser detectado. Isto foi explicado pelas energias relativas desfavoráveis dos componentes individuais do composto que dificultaram a transferência eficiente de energia a partir da matriz de quelato de íons Es 3+. Conclusão similar foi elaborado para outros actinides amerício, berquélio e fermium.
A luminescência de iões Es 3+ foi no entanto observada em soluções de ácido clorídrico inorgânicos, bem como na solução orgânica com carbonato de di (2-etilhexil) do ácido ortofosfórico. Ela mostra um pico largo a cerca de 1064 nanómetros (meia largura de cerca de 100 nm) que pode ser animado ressonantemente pela luz verde (cerca de 495 nm de comprimento de onda). A luminescência tem uma vida útil de vários microssegundos e o rendimento quântico abaixo de 0,1%. O relativamente elevado, em comparação com lantanídeos, taxas de decaimento não-radiativos em Es 3+ foram associados com a interação mais forte de f-elétrons com os Es 3+ elétrons internos.
Aplicações
Não há quase nenhum uso para qualquer isótopo de einsteinium fora da investigação científica de base visando a produção de maior elementos transuranianos e transactinides.
Em 1955, mendelevium foi sintetizado pela irradiação de um alvo constituído por cerca de 10 átomos de 9 253 Es no ciclotrão de 60 polegadas em Berkeley Laboratory. Os resultantes 253 Es (α, n) 256 reação Md rendeu 17 átomos do novo elemento com o número atômico do 101.
O isótopo raro einsteinium-254 é favorecido para a produção de elementos ultraheavy devido à sua grande massa, semi-vida relativamente longo de 270 dias, e disponibilidade de quantidades significativas de alguns microgramas. Assim einsteinium-254 foi utilizado como um alvo na tentativa de síntese ununénnio (elemento 119) em 1985 bombardeando-o com cálcio-48 íons no superHILAC acelerador linear em Berkeley, Califórnia. Não foram identificados quaisquer átomos, estabelecimento de um limite superior para a secção transversal desta reacção em 300 nanobarns.
Einsteinium-254 foi usado como o marcador no espectrómetro de calibração análise química (" analisador de superfície ") da espalhando-alfa Surveyor 5 sonda lunar. A grande massa deste isótopo reduziu a sobreposição espectral entre os sinais a partir do marcador e os elementos mais leves estudadas da superfície lunar.
Segurança
A maioria dos dados toxicidade einsteinium disponível provém de pesquisa com animais. Após a ingestão por ratos, apenas cerca de 0,01% einsteinium termina na corrente sanguínea. A partir daí, cerca de 65% vai para os ossos, onde permanece durante cerca de 50 anos, 25% para os pulmões (meia-vida biológica de cerca de 20 anos, embora este é processado irrelevante pelas curtas semividas dos isótopos einsteinium), 0,035 % para os testículos ou 0,01% para os ovários - onde einsteinium permanece indefinidamente. Cerca de 10% da quantidade ingerida é excretada. A distribuição de einsteinium sobre as superfícies ósseas é uniforme e é semelhante ao de plutónio.
![\ Mathrm {^ {238} _ {\ 92} L \ \ xrightarrow [-2 \ \ beta ^ -] {+ \ 6 \ (n, \ gamma)} \ ^ {244} _ {\ 94}} Pu](../../images/1516/151667.png)
![\ Mathrm {^ {238} _ {\ 92} L \ \ xrightarrow [6 \ beta ^ -] {+ \ 15 n} \ ^ {253} _ {\ 98} Cf \ \ xrightarrow {\ beta ^ -} \ ^ {253} _ {\ 99}} Es](../../images/1516/151668.png)
![\ Mathrm {^ {252} _ {\ 98} Cf \ \ xrightarrow {(n, \ gamma)} \ ^ {253} _ {\ 98} Cf \ \ xrightarrow [17.81 \ d] {\ beta ^ -} \ ^ {253} _ {\ 99} Es \ \ xrightarrow {(n, \ gamma)} \ ^ {254} _ {\ 99} Es \ \ xrightarrow [] {\ beta ^ -} \ ^ {254} _ { 100}} Fm](../../images/1516/151669.png)
![\ Mathrm {^ {253} _ {\ 99} Es \ \ xrightarrow [20 \ d] {\ alpha} \ ^ {249} _ {\ 97} Bk \ \ xrightarrow [314 \ d] {\ beta ^ -} \ ^ {249} _ {\ 98}} Cf](../../images/1516/151674.png)
![\ Mathrm {^ {249} _ {\ 98} Cf \ + \ ^ {2} _ {1} D \ \ longrightarrow \ ^ {248} _ {\ 99} Es \ + \ 3 \ ^ {1} _ { 0} n \ quad (^ {248} _ {\ 99} Es \ \ xrightarrow [27 \ min] {\ epsilon} \ ^ {248} _ {\ 98} Cf)}](../../images/1516/151679.png)
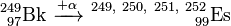
![\ Mathrm {^ {252} _ {\ 98} Cf \ \ xrightarrow {(n, \ gamma)} \ ^ {253} _ {\ 98} Cf \ \ xrightarrow [17.81 \ d] {\ beta ^ -} \ ^ {253} _ {\ 99}} Es](../../images/1516/151681.png)