
Bromo
Fundo para as escolas Wikipédia
Crianças SOS tentou tornar o conteúdo mais acessível Wikipedia por esta selecção escolas. Um link rápido para o patrocínio criança é http://www.sponsor-a-child.org.uk/
| Bromo | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
35 Br | |||||||||||||||||||
| |||||||||||||||||||
| Aparência | |||||||||||||||||||
| gás / líquido: vermelho-marrom sólida: brilho metálico  | |||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||
| Nome, símbolo, número | bromo, Br, 35 | ||||||||||||||||||
| Pronúncia | / b r oʊ m Eu n / BROH -meen ou / b r oʊ m ɨ n / BROH -min | ||||||||||||||||||
| Categoria Metallic | halogéneo | ||||||||||||||||||
| Grupo, período, bloco | (17) átomos de halogénio , 4, p | ||||||||||||||||||
| Peso atômico padrão | 79,904 (1) | ||||||||||||||||||
| Configuração eletrônica | [ Ar ] 4s 2 3d 10 4p 5 2, 8, 18, 7 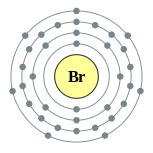 | ||||||||||||||||||
| História | |||||||||||||||||||
| Descoberta | Antoine Balard e Jérôme Leopold Gmelin (1825) | ||||||||||||||||||
| Primeiro isolamento | Antoine Jérôme Balard e Leopold Gmelin (1825) | ||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||
| Fase | líquido | ||||||||||||||||||
| Densidade (perto RT) | (Br 2, líquido) 3,1028 g · cm -3 | ||||||||||||||||||
| Ponto de fusão | 265,8 K , -7,2 ° C, 19 ° F | ||||||||||||||||||
| Ponto de ebulição | 332,0 K, 58,8 ° C, 137,8 ° F | ||||||||||||||||||
| Ponto crítico | 588 K, 10,34 MPa | ||||||||||||||||||
| Calor de fusão | (Br 2) 10,571 kJ mol -1 · | ||||||||||||||||||
| Calor de vaporização | (Br 2) 29,96 kJ · mol -1 | ||||||||||||||||||
| Capacidade calorífica molar | (Br 2) 75,69 J · · mol -1 K -1 | ||||||||||||||||||
| Pressão de vapor | |||||||||||||||||||
| |||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||
| Estados de oxidação | 7, 5, 4, 3, 1, -1 (Fortemente ácida óxido) | ||||||||||||||||||
| Eletronegatividade | 2,96 (escala de Pauling) | ||||||||||||||||||
| Energias de ionização | 1º: 1139,9 kJ · mol -1 | ||||||||||||||||||
| Segunda: 2103 kJ mol -1 · | |||||||||||||||||||
| 3: 3470 kJ · mol -1 | |||||||||||||||||||
| Raio atômico | 120 pm | ||||||||||||||||||
| O raio de covalência | 120 ± 15:00 | ||||||||||||||||||
| Van der Waals raio | 185 pm | ||||||||||||||||||
| Miscelânea | |||||||||||||||||||
| A estrutura de cristal | orthorhombic  | ||||||||||||||||||
| Ordenamento magnético | diamagnetic | ||||||||||||||||||
| Resistividade elétrica | (20 ° C) de 7,8 x 10 10 Ω · m | ||||||||||||||||||
| Condutividade térmica | 0,122 W · m -1 · K -1 | ||||||||||||||||||
| Velocidade do som | (20 ° C) 206 m · s -1 | ||||||||||||||||||
| Número de registo CAS | 7726-95-6 | ||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||
| Ver artigo principal: Os isótopos de bromo | |||||||||||||||||||
| |||||||||||||||||||
Bromo (a partir de grego : βρῶμος, brómos, que significa "mau cheiro (de bodes)") é um elemento químico com o símbolo Br, e número atômico de 35. É o grupo halogéneo (17) . O elemento foi isolado de forma independente por dois químicos, Carl Jacob e Löwig Antoine Jerome Balard, em 1825-1826. Bromo elementar é um líquido vermelho-acastanhado vaporizado à temperatura ambiente, corrosivo e tóxico, entre aqueles com propriedades de cloro e iodo . Bromo livre não ocorre na natureza, mas ocorre sais solúveis incolores halogeneto mineral cristalino, análogo ao sal de mesa.
O bromo é mais raro do que cerca de três quartos de elementos na crosta da Terra; No entanto, a elevada solubilidade do ião brometo causou a sua acumulação nos oceanos, e comercialmente o elemento é facilmente extraída a partir de misturas de salmoura, principalmente nos Estados Unidos, Israel e China. Sobre 556.000 toneladas foram produzidas em 2007, um montante semelhante ao muito mais abundante elemento magnésio .
A temperaturas elevadas, organobromadas compostos são facilmente convertidos em átomos de bromo livres, um processo que atua de rescindir química radical livre reações em cadeia. Isso faz com que tais compostos úteis retardadores de fogo e isso é uso industrial principal do bromo, que consome mais de metade da produção mundial do elemento. A mesma propriedade permite compostos organobromadas voláteis, sob a acção da luz solar, para formar átomos livres de bromo na atmosfera que são altamente eficazes na depleção de ozono . Este efeito colateral indesejado tem causado muitos orgânicos voláteis bromados comuns como brometo de metilo, um pesticida que antigamente era um grande consumidor de bromo industrial, de ser abandonado. Restantes utilizações de compostos de bromo são em perfuração de poços fluidos, como um intermediário no fabrico de produtos químicos orgânicos e em filme fotográfico.
Bromo não tem nenhuma função essencial em mamíferos, embora seja preferencialmente utilizada sobre cloreto por uma enzima antiparasitária no sistema imunológico humano. Organobromides são necessários e produzida enzimaticamente a partir de brometo de algumas formas de vida inferiores, no mar, em particular algas , e as cinzas de algas marinhas foi uma fonte de descoberta de bromo. Como um produto farmacêutico, o ião brometo simples, Br -, tem efeitos inibidores sobre o sistema nervoso central, e sais de brometo foram uma vez um grande sedativo médica, antes de ser substituído por drogas de acção mais curtas. Eles mantêm nicho usa como antiepilépticos.
Características
Físico

Bromo elementar existe como um molécula diatomic, Br 2. É um, móvel, líquido castanho-avermelhado ligeiramente transparente denso, que evapora facilmente no temperatura padrão e as pressões para dar um vapor laranja (suas cores se assemelha dióxido de azoto), que tem um odor desagradável que se assemelha fortemente a de cloro . É apenas um dos dois elementos da tabela periódica que são conhecidos por serem líquidos à temperatura ambiente ( o mercúrio é o outro, embora césio , gálio , e rubídio derreter apenas acima da temperatura ambiente).
A uma pressão de 55 GPa (pressão atmosférica a cerca de 540.000 vezes) de bromo converte em uma de metal . A 75 GPa converte em uma cara centrado estrutura ortorrômbica. Em 100 GPa converte em uma forma monoatomic orthorhombic corpo centrado.
Químico
Sendo menos reactivo do que o cloro , mas mais reactivo do que o iodo , o bromo reage vigorosamente com metais, especialmente na presença de água, para dar sais de brometo. É também reactivos com a maioria dos compostos orgânicos, especialmente sobre iluminação, condições que favorecem a dissociação da molécula diatómica em radicais de bromo:
- Br 2
 2 Br ·
2 Br ·
Ele liga facilmente com diversos elementos e tem um forte acção de branqueamento.
O bromo é ligeiramente solúvel em água , mas é altamente solúvel em solventes orgânicos, tais como dissulfureto de carbono, tetracloreto de carbono , alifáticos álcoois e ácido acético .
Isótopos
Bromo tem dois estáveis isótopos , 79 Br (50,69%) e 81 Br (49,31%). Pelo menos 23 outras radioisótopos são conhecidos. Muitos dos isótopos de bromo são produtos de fissão. Vários dos isótopos mais pesados de bromo de fissão são atrasados emissores de nêutrons. Todos os isótopos radioativos de bromo são relativamente curta. A meia-vida mais longa é o nêutron deficiente 77 Br em 2,376 dias. A mais longa meia-vida em nêutron lado os ricos é de 82 Br em 1,471 dias. Um certo número de isótopos de bromo exibem isómeros metaestáveis. Estável 79Br exibe uma radioactivos isómero, com uma meia-vida de 4,86 segundos. Ele decai por transição isomérica ao estado fundamental estável.
História
Bromo foi descoberto independentemente por dois químicos, Carl Jacob e Löwig Antoine Balard, em 1825 e 1826, respectivamente.
Balard encontrados produtos químicos brometo nas cinzas de algas do pântanos de sal de Montpellier. A alga foi usada para produzir iodo, mas também continha bromo. Balard destilada a uma solução de bromo a partir de cinzas de algas marinhas saturado com cloro. As propriedades da substância resultante foi semelhante àquela de um intermediário de cloro e iodo; Com estes resultados, ele tentou provar que a substância era monocloreto de iodo (ICI), mas depois de não conseguir fazê-lo, ele estava certo de que tinha encontrado um novo elemento e nomeou-muride, derivado dos latino- muria palavra para salmoura.
Löwig isolado bromo a partir de uma nascente de água mineral de sua cidade natal Bad Kreuznach em 1825. Löwig utilizada uma solução do sal mineral saturada com cloro e extraiu-se o bromo com éter dietílico. Após a evaporação do éter um líquido castanho permaneceu. Com este líquido como uma amostra para o seu trabalho ele se candidatou a um cargo no laboratório de Leopold Gmelin em Heidelberg. A publicação dos resultados foi adiada e Balard publicou seus resultados em primeiro lugar.
Após os químicos franceses Louis Nicolas Vauquelin, Louis Jacques Thénard, e Joseph-Louis Gay-Lussac aprovou as experiências dos jovens farmacêutico Balard, os resultados foram apresentados em uma conferência da Académie des Sciences e publicado no Annales de Chimie et Physique. Em sua publicação Balard afirma que ele mudou o nome de muride para Brome sobre a proposta de M. Anglada. (Brome (bromo) deriva do grego βρωμος (mau cheiro).) Outras fontes afirmam que o químico e físico francês Joseph-Louis Gay Lussac-sugeriu a brome nome para o cheiro característico dos vapores. Bromo não foi produzido em grandes quantidades até 1860.
O primeiro uso comercial, para além de algumas aplicações médicas menores, foi o uso de bromo para o daguerreótipo. Em 1840 descobriu-se que tinha bromo algumas vantagens sobre a vapor de iodo utilizado para criar o anteriormente sensível à luz camada de haleto de prata utilizada para daguerreotipia.
Brometo de potássio e brometo de sódio foram usadas como e anticonvulsivantes sedativos no final dos anos 19 e início do século 20, até que eles foram gradualmente substituídas por hidrato de cloral e, em seguida, o barbitúricos.
Ocorrência

O elemento diatómico Br 2 não ocorre naturalmente. Em vez disso, existe exclusivamente como bromo sais de brometo em quantidades difusos em crustal rocha. Devido a lixiviação, sais de brometo ter acumulado na água do mar a 65 parte por milhão (ppm), o que é menos do que o cloreto. Bromo pode ser economicamente recuperados a partir de poços de salmoura rica em brometo e do Mar Morto águas (até 50.000 ppm). Ela existe na crosta da Terra a uma concentração média de 0,4 ppm, tornando-o o 62 elemento mais abundante. A concentração de bromo em solos normalmente varia entre 5 e 40 ppm, mas alguns solos vulcânicos pode conter até 500 ppm. A concentração de bromo na atmosfera é extremamente baixo, de apenas uns poucos ppt. Um grande número de compostos organobromadas são encontrados em pequenas quantidades na natureza.
Bromo reservas da China estão localizados na Província de Shandong e reservas de bromo de Israel estão contidos nas águas do Mar Morto . A maior reserva de bromo nos Estados Unidos está localizado em Columbia County e Union County, Arkansas, EUA
Produção
Produção de bromo é bastante dinâmico e aumentou seis vezes desde a década de 1960. Cerca de 556 mil toneladas (valor de cerca de US $ 2,5 bilhões) foi produzido em 2007 em todo o mundo, com a contribuição predominante do Estados Unidos (226.000 t) e Israel (210 mil t). Produção dos EUA foi excluído da United States Geological Survey depois de 2007, e das 380 mil toneladas minadas por outros países em 2010, 140 mil t foram produzidos pela China, 130 mil t por Israel e 80.000 t por Jordan.
Salmouras ricas em brometo são tratados com gás de cloro, rubor através de ar. Neste tratamento, aniões brometo são oxidados pelo bromo cloro gasoso.
- 2 Br - + Cl 2 → 2 Cl - + Br2
Os métodos de laboratório de produção
No laboratório, devido à sua disponibilidade comercial e longa vida de prateleira, bromo não é tipicamente preparada. Pequenas quantidades de bromo pode, contudo, ser gerado através da reacção de um sólido brometo de sódio concentrado com ácido sulfúrico (H 2 SO 4). A primeira fase é a formação de brometo de hidrogénio (HBr), que é um gás, mas sob as condições de reacção um pouco da HBr é oxidado adicionalmente por o ácido sulfúrico para formar o bromo (Br2) e dióxido de enxofre (SO2).
- NaBr (s) + H 2 SO 4 (aq) → HBr (aq) + NaHSO4 (aq)
- 2 HBr (aq) + H 2 SO 4 (aq) → Br 2 (g) + SO2 (g) + 2H 2 O (l)
Alternativas de ácidos não oxidantes, tais como a utilização de ácido bromídrico diluído ácido com sódio hipobromito, também estão disponíveis, como o ácido hipobromoso formado a partir deles é instável na presença de brometo, sendo reduzida por isso de acordo com a reacção:
- 2 OBr - (aq) + 4 HBr (aq) → 2Br 2 + 2H 2 O + 2q -
As reacções são o inverso de reacções de desproporcionação bromo elementar na base, e são chamados comproporcionação. Uma reacção semelhante acontece com hipoclorito de sódio, ácido, e cloreto, levando à utilização de cloro elementar.
As reacções envolvendo um agente oxidante, tal como permanganato de potássio ou dióxido de manganês, de iões brometo, na presença de um ácido, também dar bromo nas reacções análogas à formação de cloro e iodo elementar a partir de um ácido e de oxidante.
Como o iodo, o bromo é solúvel em clorofórmio, mas apenas ligeiramente solúvel em água. Em água, a solubilidade pode ser aumentada pela presença de iões brometo. As soluções concentradas de bromo raramente são preparados no laboratório por causa de riscos. Como é o caso com soluções de cloro ou de soluções de iodo, tiossulfato de sódio (ou qualquer tiossulfato solúvel) é um reagente eficaz para a redução de brometo de bromo incolor e inodoro, assim, tratar manchas e odor do elemento em locais indesejados. Pela mesma razão, tiossulfato ("hipo do fixador") é usado em fotografia de lidar com bromo livre em emulsões de brometo de prata de película.
Compostos e química
Química orgânica
Tal como acontece com outros halogênios, substitutos de bromo para o hidrogênio em hidrocarbonetos, ligação covalente de carbono. Como com outros halogéneos, o produto C-Br desta substituição é geralmente incolor se o composto correspondente é CH incolor. A adição de bromo ligado covalentemente tende a aumentar a densidade e aumentar o ponto de fusão de compostos orgânicos.
Os compostos orgânicos são bromados por qualquer Adicionalmente ou reacções de substituição. Bromo sofre adição eletrofílica às duplas ligações de alcenos , através de um intermediário cíclico bromônio. Em solventes não-aquosos, tais como dissulfureto de carbono, isto resulta o produto di-bromo. Por exemplo, a reacção com etileno produza 1,2-dibromoetano. O bromo sofre também adição electrófila para fenóis e anilinas. Quando usado como água de bromo, uma pequena quantidade do correspondente bromidrina é formado, bem como o composto dibromo. Assim fiável é a reactividade de bromo que a água de bromo é empregue como um reagente para detectar a presença de alcenos, fenóis e as anilinas. Tal como os outros halogéneos, bromo participa reacções de radicais livres. Por exemplo, os hidrocarbonetos são bromado por tratamento com bromo na presença de luz.
O bromo, por vezes, com uma quantidade catalítica de fósforo , brominates facilmente ácidos carboxílicos na posição α. Este método, o Hell-Volhard reacção-Zelinsky, é a base para a rota comercial ácido bromoacético. N-bromossuccinimida é comumente utilizado como um substituto para o bromo elementar, sendo mais fáceis de manusear, e a reacção mais suavemente e, assim, de forma mais selectiva. Brometos orgânicos são muitas vezes preferível em relação aos cloretos de menos reactivos e reagentes contendo iodeto mais caros. Assim, De Grignard e de organolítio composto na maioria das vezes são gerados a partir dos brometos correspondentes.
Certos compostos relacionados com o bromo ter sido avaliada para ter um destruição do ozônio ou potencial acumulam nos organismos vivos. Como resultado, muitos compostos de bromo industrial não são mais fabricados, estão a ser restrito, ou programada para a eliminação gradual. O Protocolo de Montreal menciona vários compostos organobromadas para esta fase para fora.
Química inorgânica
Compostos de bromo inorgânicos adoptar uma variedade de estados de oxidação de -1 a +7. Na natureza, brometo (Br -) é, de longe, o estado mais comum, e as partidas deste -1 estado de oxidação são inteiramente devido a organismos vivos e do brometo de interação com oxidantes produzidos biologicamente, tais como oxigênio livre.
Como outros halogéneos, ião brometo é incolor, e forma uma série de sais minerais iónicos transparentes, análogo ao cloreto. O ião brometo é altamente solúvel em água.
Exemplos de compostos para vários estados de oxidação de bromo são mostrados abaixo:
| Estados de oxidação de bromo | |
|---|---|
| -1 | HBr |
| 0 | Br 2 |
| +1 | BrCl |
| +3 | BrF 3 |
| 5 | BrF 5 |
| 5 | BrO - 3 |
| +7 | BrO - 4 |
O bromo é um oxidante, e que vai oxidar iões iodeto para iodo, sendo em si reduzida a brometo:
- Br 2 + 2 I - → 2 Br - + I 2
Bromo também irá oxidar os metais e metalóides para os brometos correspondentes. Bromo anidra é menos reactiva para os metais do que muitos bromo hidratado, no entanto. Bromo seco reage vigorosamente com alumínio , titânio , mercúrio , bem como alcalino-terrosos e metais alcalinos .
Dissolver bromo em solução alcalina dá uma mistura de brometo e hipobromito:
- Br2 + 2 OH - → Br - OBr + - + H2O
Este hipobromito é responsável pelas habilidades de branqueamento de soluções de brometo. O aquecimento destas soluções faz com que a reacção de desproporção do hipobromito para dar bromato, um forte agente oxidante muito semelhante ao clorato.
- 3 BrO - → BrO -
3 + 2 Br -
Em contraste com a via de percloratos, perbromates não são acessíveis por meio de electrólise, mas apenas por reacção de soluções de bromato com flúor ou ozono .
- BrO 3 - + H 2 O + F 2 → BrO -
4 2 + HF - BrO 3 - + O 3 → BrO -
4 + O 2
Bromo reage violentamente e explosivamente com o metal de alumínio, formando brometo de alumínio:
- 2 Al + 3 Br 2 2 → AlBr 3
O bromo reage com hidrogénio sob a forma gasosa e dá brometo de hidrogénio:
- H2 + Br2 2 → HBr
Bromo reage com metais alcalinos iodetos em uma reacção de deslocamento. Esta reacção forma brometos de metais alcalinos e produz elementar iodo :
- 2 Nal + Br 2 → 2 NaBr + I2
- 2 KI + Br 2 → 2 KBr + I2
Aplicações
Uma grande variedade de compostos são utilizados em organobromadas indústria . Alguns são preparados a partir de bromo e outros são preparados a partir de brometo de hidrogénio, o qual é obtido por combustão de hidrogénio em bromo.
Ilustrativo da reacção de adição é a preparação de 1,2-dibromoetano, o composto organobromadas produzido em maiores quantidades:
- C 2 H 4 + Br2 → CH2 BrCH2 Br
Retardante de chama
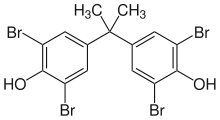
Retardadores de chama bromados representam uma mercadoria de importância crescente, e representam a maior utilização comercial de bromo. Quando o material bromado queima, o retardador de chama produz ácido bromídrico que interfere no radical reacção em cadeia da reacção de oxidação do fogo. O mecanismo é que os radicais altamente reactivos de hidrogénio, radicais de oxigénio e os radicais hidroxi reagir com ácido bromídrico para formar os radicais de bromo menos reactivos (isto é, átomos de bromo livre). Átomos de bromo pode também reagir directamente com outros radicais para ajudar a terminar a cadeia reacções de radicais livres que caracterizam combustão.
Para produzir polímeros e plásticos bromados, compostos contendo bromo pode incorporada no polímero durante polimerização. Um método é o de incluir uma quantidade relativamente pequena de monómero bromado durante o processo de polimerização. Por exemplo, brometo de vinilo podem ser utilizados na produção de polietileno, cloreto de polivinilo ou polipropileno. Moléculas altamente bromados específicas também pode ser adicionado que participam no processo de polimerização, por exemplo, tetrabromobisfenol A pode ser adicionado ao de poliésteres ou de resinas epóxi, onde se torna parte do polímero. Epoxys utilizado em placas de circuito impresso são normalmente feitas de tal f r etardant lame resinas, indicados pela FR na abreviatura dos produtos ( FR-4 e FR-2). Em alguns casos, o composto contendo bromo pode ser adicionado depois da polimerização. Por exemplo, éter decabromodifenílico podem ser adicionados aos polímeros finais.
Um número de bromado ou gasoso altamente volátil halomethane compostos não são tóxicos e tornar agentes supressores de fogo superior por este mesmo mecanismo, e é especial eficaz em espaços fechados, tais como submarinos, aviões e naves espaciais. No entanto, eles são caros e sua produção e uso tem sido muito reduzido devido ao seu efeito como agentes de destruição do ozono. Eles não são mais usados em extintores de incêndio de rotina, mas mantêm nicho usa em aplicações aeroespaciais e de supressão de fogo automáticas militares. Eles incluem bromoclorometano (Halon 1011, CH 2 BrCl), bromochlorodifluoromethane (Halon 1211, CBrClF 2), e bromotrifluormetano (Halon 1301, CBrF 3).
Aditivo da gasolina
Brometo de etileno era uma aditivo em gasolinas que contêm chumbo anti- motor de agentes de bater. Limpa de chumbo através da formação de brometo de chumbo volátil, que se esgota a partir do motor. Esta aplicação foi responsável por 77% do uso de bromo em 1966 em os EUA. Esta aplicação tem declinado desde a década de 1970 devido aos regulamentos ambientais (ver abaixo).
Pesticida
Venenoso brometo de metilo foi amplamente utilizado como pesticida fumigar o solo e para fumigar habitação, pelo método tenting. Brometo de etileno foi usada de forma semelhante. Estes compostos voláteis organobromadas estão todos agora regulamentada como de destruição do ozono agentes. O Protocolo de Montreal sobre Substâncias que Destroem a Ozone prevista a eliminação para o ozono produto químico até 2005, e pesticidas organobromide não são mais usados (em fumagation habitação eles foram substituídos por compostos tais como fluoreto de sulfurilo, que contêm nem o cloro ou bromo orgânicos que prejudicam o ozônio). Antes do protocolo de Montreal, em 1991 (por exemplo) um número estimado de 35 mil toneladas do produto químico foram usados para controlar nematóides , fungos , plantas daninhas e outras doenças do solo.
Médicos e veterinários

Use. Compostos brometo, especialmente brometo de potássio, foram frequentemente utilizados como sedativos gerais no século 19 e início do século 20. Brometo, na forma de sais simples são ainda usados como anticonvulsivos em ambas medicina humana e veterinária, embora esta última utilização varia de país para país. Por exemplo, os EUA O Food and Drug Administration (FDA) não aprova o brometo para o tratamento de qualquer doença, e foi removido de over-the-counter produtos como sedativos Bromo-Seltzer, em 1975. Assim, os níveis de brometo não são rotineiramente medidos por laboratórios médicos em os EUA No entanto, veterinários americanos laboratórios de ensaio de diagnóstico médico irá medir os níveis de brometo de sangue, a pedido, como uma ajuda para o tratamento de epilepsia em cães.
Toxicidade. O uso a longo prazo de brometo de potássio (ou qualquer sal brometo) pode conduzir a bromism. Este estado de depressão do sistema nervoso central provoca a toxicidade moderada de brometo em doses multi-grama para os humanos e outros mamíferos. A semi-vida muito longo de ião brometo no corpo (~ 12 dias), também contribui para a toxicidade a partir de brometo de acumulação de fluidos corporais. Ingestão de brometo também pode causar uma erupção cutânea que se assemelha acne .
Outros usos
- Os brometos de cálcio, sódio, zinco e conta para uma parte considerável do mercado de bromo. Estes sais formam soluções densos em água que são utilizados como fluidos de perfuração às vezes chamado de fluidos salmoura claras.
- O bromo é também utilizada na produção de óleo vegetal bromado, que é utilizado como um emulsionante em muitos citrus -flavored refrigerantes (por exemplo, Mountain Dew). Após a introdução na década de 1940 o composto foi amplamente utilizado até que o Reino Unido e os EUA limitam seu uso em meados dos anos 1970 e emulsificantes alternativos foram desenvolvidos.
Refrigerantes que contêm óleo vegetal bromado ainda são vendidos em os EUA (2011).
- Vários corantes, produtos agroquímicos, e farmacêuticos são compostos organobromadas. 1-bromo-3-cloropropano, 1-bromoetilbenzeno, e 1-bromoalkanes são preparados pela antimarkovnikov adição de HBr a alcenos. O brometo de etídio, EtBr, é usado como um ADN mancha em electroforese em gel.
- Alto compostos de índice de refracção
- Bromo, como o cloro, é usada na manutenção de piscinas, especialmente spas (banheiras de hidromassagem), onde é gerada in situ a partir de um brometo além de peróxido de hidrogênio. Em spas, as altas temperaturas da água rende compostos de purificação de água e tamponantes clorados instável, e compostos de bromo pode melhorar a vida da antimicrobiana livre de halogênio.
- Purificação da água , compostos desinfetantes e insecticidas, tais como tralometrina (C 22 H 19 NO 3 Br 4).
- Brometo de potássio é utilizado em alguns reveladores fotográficos para inibir a formação de nevoeiro (redução indesejada de prata).
- Vapor de bromo é utilizado como o segundo passo em sensibilizante placas daguerreótipo a ser desenvolvido no âmbito de vapor de mercúrio. Bromo age como um acelerador para a sensibilidade à luz da placa previamente iodado.
- Bromo também é usado para reduzir a poluição de mercúrio das usinas de energia movidas a carvão. Isto pode ser conseguido quer por tratamento carvão activado com bromo ou por injecção de compostos de bromo para o carvão antes da combustão.
- O bromo pode também ser substituído artificialmente para o substituinte metilo na timina base azotada de ADN, criação de o análogo de base de 5-bromouracilo. Quando esta base é incorporada no ADN suas diferentes propriedades de ligação de hidrogénio pode causar mutação no local do referido par de bases. O composto 5-bromouracilo é, portanto, um agente mutagénico artificial.
Papel biológico

Bromo não tem um papel essencial conhecido na saúde humana ou de mamífero, mas bromo inorgânico e organobromadas compostos que ocorrem naturalmente, e alguns podem ser de uso para os organismos mais elevados em lidar com parasitas. Por exemplo, na presença de H 2 O 2 formados pela eosinófilos, e ou cloreto ou iões brometo, eosinófilos peroxidase fornece um mecanismo potente pelo qual eosinófilos matar multicelular parasitas (tal como, por exemplo, os vermes nematóides envolvido em filariose); e também certas bactérias (como a tuberculose bactérias). Peroxidase de eosinófilos é um haloperoxidase que preferencialmente utiliza brometo sobre cloreto de para este efeito, gerando hipobromito ( ácido hipobromoso).
Os organismos marinhos são a principal fonte de compostos organobromadas. Mais de 1600 compostos foram identificados através de 1999. A mais abundante é brometo de metilo (CH3Br) com uma estimativa de 56.000 toneladas produzidas por algas marinhas cada ano. O óleo essencial da alga Hawaiian Taxiformis Asparagopsis consiste de 80% de brometo de metilo. A maior parte de tais compostos organobromadas no mar são feitos através da acção de uma enzima de algas original, vanádio Bromoperoxidase. Embora esta enzima é o criador o mais prolífico de brometos orgânicos por organismos vivos, outro bromoperoxidases existem na natureza que não utilizam vanádio.
Um exemplo famoso de um composto orgânico contendo bromo que tem sido utilizado pelos seres humanos desde os tempos antigos é o corante de tecido Púrpura de Tiro. O bromados corante índigo indole é produzido por uma de tamanho médio- mar predatório caracol, o marinho gastrópode Murex brandaris. A natureza organobromadas do composto não foi descoberto até 1909 (ver Paul Friedländer).
Segurança
Bromo elementar é tóxico e provoca queimaduras. Como agente oxidante, não é compatível com a maioria dos compostos orgânicos e inorgânicos. Cuidado deve ser tomado ao transporte de bromo; é comumente realizada em tanques de aço revestidas com chumbo, apoiados por armações de metal fortes.
Quando certos compostos iónicos que contêm bromo são misturados com permanganato de potássio (KMnO4) e uma substância ácida, que irá formar uma nuvem de gás castanho pálido bromo.
- 6 Br - + 2 MnO -
4 + 8 H + → 3 Br 2 + 2 + MnO 2 4 H2O
Este gás tem cheiro de água sanitária e é muito irritante para as mucosas. Após a exposição, deve-se mudar-se para o ar fresco imediatamente. Se surgirem sintomas de envenenamento por bromo, é necessária a atenção médica.

