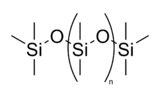Silício
Informações de fundo
Esta seleção Wikipedia está offline disponível a partir de Crianças SOS, para distribuição no mundo em desenvolvimento. Você quer saber sobre o patrocínio? Veja www.sponsorachild.org.uk
| Silício | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
14 Si | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||||
cristalino, reflexivo com rostos azulados tingida  Linhas espectrais de Silicon | |||||||||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||||||||
| Nome, símbolo, número | de silício, Si, 14 | ||||||||||||||||||||||||||||||
| Pronúncia | / s ɪ l ɨ k ən / SIL -ə-kən ou / s ɪ l ɨ k ɒ n / SIL -ə-kon | ||||||||||||||||||||||||||||||
| Categoria elemento | metalóide | ||||||||||||||||||||||||||||||
| Grupo, período, bloco | 14, 3, p | ||||||||||||||||||||||||||||||
| Peso atômico padrão | 28,085 (1) | ||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Ne ] 3s 2 3p 2 2, 8, 4 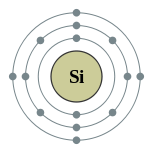 | ||||||||||||||||||||||||||||||
| História | |||||||||||||||||||||||||||||||
| Predição | Antoine Lavoisier (1787) | ||||||||||||||||||||||||||||||
| Descoberta | Jöns Jacob Berzelius (1823) | ||||||||||||||||||||||||||||||
| Primeiro isolamento | Jöns Jacob Berzelius (1823) | ||||||||||||||||||||||||||||||
| Nomeado por | Thomas Thomson (1817) | ||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||
| Densidade (perto RT) | 2,3290 g · cm -3 | ||||||||||||||||||||||||||||||
| Líquido densidade no pf | 2,57 g cm -3 · | ||||||||||||||||||||||||||||||
| Ponto de fusão | 1687 K , 1414 ° C, 2577 ° F | ||||||||||||||||||||||||||||||
| Ponto de ebulição | 3538 K, 3265 ° C, 5909 ° F | ||||||||||||||||||||||||||||||
| Calor de fusão | 50.21 kJ mol -1 · | ||||||||||||||||||||||||||||||
| Calor de vaporização | 359 kJ mol -1 · | ||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 19,789 J · · mol -1 K -1 | ||||||||||||||||||||||||||||||
| Pressão de vapor | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||||||||
| Estados de oxidação | 4, 3, 2, 1 -1, -2, -3, -4 ( óxido anfotérico) | ||||||||||||||||||||||||||||||
| Eletronegatividade | 1,90 (escala de Pauling) | ||||||||||||||||||||||||||||||
| Energias de ionização ( Mais) | 1º: 786,5 kJ · mol -1 | ||||||||||||||||||||||||||||||
| 2: 1577,1 kJ · mol -1 | |||||||||||||||||||||||||||||||
| 3: 3231,6 kJ · mol -1 | |||||||||||||||||||||||||||||||
| Raio atômico | 111 pm | ||||||||||||||||||||||||||||||
| O raio de covalência | 111 pm | ||||||||||||||||||||||||||||||
| Van der Waals raio | 210 pm | ||||||||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||||||||
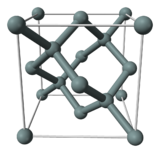
| A estrutura de cristal | diamante cúbico | ||||||||||||||||||||||||||||||
| Ordenamento magnético | diamagnetic | ||||||||||||||||||||||||||||||
| Resistividade elétrica | (20 ° C) 10 3 Ω · m | ||||||||||||||||||||||||||||||
| Condutividade térmica | 149 W · m -1 · K -1 | ||||||||||||||||||||||||||||||
| Expansão térmica | (25 ° C) de 2,6 uM · · K -1 m -1 | ||||||||||||||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C) 8433 m · s -1 | ||||||||||||||||||||||||||||||
| O módulo de Young | 130-188 GPa | ||||||||||||||||||||||||||||||
| Módulo de cisalhamento | 51-80 GPa | ||||||||||||||||||||||||||||||
| Massa de módulo | 97,6 GPa | ||||||||||||||||||||||||||||||
| Rácio de Poisson | 0,064-,28 | ||||||||||||||||||||||||||||||
| Dureza de Mohs | 7 | ||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-21-3 | ||||||||||||||||||||||||||||||
| Banda energia lacuna a 300 K | 1.12 eV | ||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de silício | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
Silicone, uma tetravalente metalóide, é um elemento químico com o símbolo Si e número atômico 14. Ele é menos reactivo do que o seu análogo químico de carbono , o metalóide, directamente por cima da tabela periódica , mas mais reactivo do que o germânio , o metalóide directamente abaixo na tabela. A controvérsia sobre as datas de caráter de silício para a sua descoberta; ele foi preparado primeiro e caracterizada na sua forma pura em 1823. Em 1808, foi dado o nome de silício (a partir Latina : Silicis, pedras), com uma ónio para sugerir um metal-ending palavra, um nome que o elemento mantém em vários idiomas diferentes do inglês. No entanto, seu nome final Inglês, sugerida pela primeira vez em 1817, reflete o mais fisicamente semelhante elementos carbono e boro.
O silício é o oitavo mais elemento comum no universo, em massa, mas muito raramente ocorre como elemento livre na natureza pura. É mais amplamente distribuído em poeiras, areias , planetóides e planetas como várias formas de dióxido de silício (sílica) ou silicatos. Mais de 90% da crosta terrestre é composta por minerais de silicato, tornando o silício segundo elemento mais abundante na crosta da Terra (cerca de 28% em massa) depois de oxigênio .
A maioria de silício é utilizado comercialmente sem ser separados e, de fato, muitas vezes com pouco processamento de compostos de natureza. Estes incluem-uso edifício industrial direta das argilas, areia de sílica e pedra. A sílica é utilizado em tijolos cerâmicos. Silicato entra Cimento Portland para argamassa e estuque, e quando combinado com a areia de sílica e cascalho, para fazer concreto. Silicatos também estão em porcelana, faiança cerâmicas, tais como porcelana, e na tradicional quartzo baseados vidro de soda-cal. Mais compostos de silício modernas, tais como silício abrasivos formulário de carboneto e cerâmicas de alta resistência. O silício é a base dos polímeros sintéticos à base de silício ubíquos chamada silicones.
Silício elementar também tem um grande impacto sobre a economia mundial moderna. Embora a maioria de silício livre é usado no refino do aço, alumínio de fundição, e química fina (muitas vezes para fazer sílica fumada), a porção relativamente pequena de silício altamente purificada, que é utilizado em tecnologias de semicondutores electrónica (<10%) é talvez ainda mais crítico. Por causa da ampla utilização de silício em circuitos integrados , a base da maioria dos computadores, uma grande quantidade de tecnologia moderna depende disso.
O silício é um elemento essencial na biologia, embora apenas pequenos vestígios de que parece ser exigido pelos animais. No entanto, várias esponjas do mar, bem como microorganismos, como diatomáceas precisa de silício a fim de ter a estrutura. É muito mais importante para o metabolismo das plantas, particularmente muitas gramíneas.
Características
Físico
O silício é um sólido à temperatura ambiente, com relativamente elevada de fusão e pontos de ebulição de cerca de 1400 e 2800 graus Celsius, respectivamente. Curiosamente, o silício tem uma maior densidade no estado líquido do que um estado sólido. Ele não se contrai quando se congela como a maioria das substâncias, mas expande-se, da mesma forma como o gelo é menos denso do que a água e tem menos massa por unidade de volume do que a água líquida. Com uma relativamente alta condutividade térmica de 149 W · m -1 · K-1, silício conduz bem o calor e, como resultado não é muitas vezes usado para isolar objetos quentes.
Na sua cristalina forma, silício puro tem uma cor cinza e um brilho metálico. Como germânio , silício é bastante forte, muito frágil e propenso a lascar. De silício, como o carbono e germânio, cristaliza numa diamante cúbico estrutura de cristal, com um espaçamento de rede de 0.5430710 nm (5.430710 Â).
O exterior elétron orbital de silício, como o de carbono, tem quatro elétrons de valência. Os 1 s, 2 s 2, 3 e p s subshells estão completamente preenchidos enquanto o subnível 3 p contém dois elétrons de um total possível de seis.
O silício é um semicondutor . Ele tem um coeficiente de temperatura negativo de resistência , uma vez que o número de portadores de carga livres aumenta com a temperatura. A resistência eléctrica de silício monocristalino muda significativamente sob a aplicação de tensão mecânica devido à efeito piezoresistivo.
Químico
O silício é um metalóide, prontamente, quer doar ou partilhar seus quatro elétrons externos, permitindo a muitas formas de ligação química. Como o carbono, que normalmente faz quatro ligações. Ao contrário de carbono, ele pode aceitar elétrons adicionais e formar cinco ou seis títulos em um às vezes mais lábil forma de silicato. Silício tetra-valente é relativamente inerte, mas ainda reage com halogéneos e diluído álcalis, mas a maioria dos ácidos (excepto para algumas combinações de hiper-reactivo de ácido nítrico e ácido fluorídrico) tem nenhum efeito conhecido sobre ele. No entanto, tendo quatro elétrons de ligação dá-lo, como o carbono, muitas oportunidades para combinar com outros elementos ou de compostos sob as circunstâncias corretas.
Isótopos
Naturalmente que ocorre silício é composto por três estáveis isótopos , silício-28, 29-silício e silício-30, com silício-28, sendo o mais abundante (92% abundância natural). Destes, apenas a silício-29 é de utilização em RMN e Espectroscopia de EPR. Vinte radioisótopos foram identificados, sendo os mais estáveis o silício-32 com uma semi-vida de 170 anos e silício-31 com uma semi-vida de 157,3 minutos. Todos os restantes isótopos radioativos possuem meias-vidas que são menos de sete segundos, ea maioria destes com meias-vidas que são menos de um décimo de segundo. O silício não tem qualquer conhecida isómeros nucleares.
Os isótopos de silício na gama número de massa de 22 a 44. O mais comum modo de decaimento de isótopos com seis números de massa mais baixos do que o isótopo estável mais abundante, silício-28, é β +, isótopos de alumínio que formam primariamente (13) protões como produtos de decaimento. O modo de decaimento mais comum (s) por 16 isótopos com números de massa mais elevados do que o silício-28 é β -, formando principalmente isótopos de fósforo (15 prótons) como produtos de decaimento.
Ocorrência

Medido em massa, silício compõe 27,7% da crosta terrestre e é o segundo elemento mais abundante na crosta terrestre, apenas com oxigénio tendo uma abundância maior. O silício é geralmente encontrada sob a forma de complexo silicatos minerais, e menos frequentemente como o dióxido de silício (sílica, um dos principais componentes de areia comum). Cristais de silício puro são muito raramente encontrado na natureza.
O minerais de silicatos minerais várias-que contêm silício, oxigénio e reactiva metais-conta por 90% da massa da crosta da Terra. Isto é devido ao facto de as elevadas temperaturas características de formação do sistema solar, de silício e de oxigénio tem uma grande afinidade para o outro, formando redes de silício e oxigénio em compostos químicos de muito baixa volatilidade. Desde oxigênio e silício foram os elementos não gasosas e não-metálicos mais comuns no detritos de supernova poeira que formaram a disco protoplanetário na formação e evolução do Sistema Solar, eles formaram diversos silicatos complexos, que acrescidos em maior rochoso planetesimais que formaram a planetas terrestres. Aqui, a matriz de silicato mineral reduzida aprisionado os metais reactivos suficiente para ser oxidada (de alumínio, cálcio, sódio, potássio e magnésio). Após a perda de voláteis de estufa, bem como o carbono e o enxofre através da reacção com hidrogénio, esta mistura de silicato de elementos formado a maior parte da crosta terrestre. Estes silicatos eram de densidade relativamente baixa em relação ao ferro, o níquel, e outros metais não-reactivos ao oxigénio e, assim, um resíduo de ferro não combinada e níquel afundou para o núcleo do planeta, deixando uma manta de espessura constituída essencialmente de magnésio e de ferro silicatos acima.
Os exemplos de minerais de silicato na crosta incluem aqueles no piroxênio, anfibólio, mica e feldspato grupos. Estes minerais ocorrem em argila e vários tipos de rocha , como granito e arenito.
Sílica ocorre em minerais que consiste em dióxido de silício muito pura em diferentes formas cristalinas, quartzo , ágata ametista, cristal de rocha , calcedônia, sílex, jaspe, e opala. Os cristais têm a fórmula empírica de dióxido de silício, mas não consistem em moléculas de dióxido de silício separadas na forma de dióxido de carbono sólido. Em vez disso, a sílica é estruturalmente uma consistindo de silício e oxigênio em cristais tridimensionais, como o diamante solid-rede. Sílica menos pura forma o vidro naturais obsidiana. Sílica biogénica ocorre na estrutura de diatomáceas, radiolaria e esponjas siliciosos.
Silício também é um componente principal de muitos meteoritos, e é um componente do tectitas, um mineral de silicato de origem possivelmente lunar, ou (se a Terra-derivado) que tenha sido submetido a temperaturas e pressões incomuns, possivelmente, contra a penetração de meteoritos.
Produção
Alloys
Ferrosilicon, uma liga de ferro-silício que contém razões variáveis de silício elementar e ferro, responsável por cerca de 80% da produção mundial de silicone elementar, com a China, o principal fornecedor de silício elementar, fornecendo 4,6 milhões toneladas (ou 2/3 da produção mundial) de silício, a maioria dos quais tem a forma de ferro-silício. Ele é seguido pela Rússia (610.000 t), Noruega (330.000 t), Brasil (240 mil t) e Estados Unidos (170.000 t). Ferrosilicon é utilizado principalmente pela indústria siderúrgica (ver abaixo).
As ligas de alumínio-silício são muito utilizadas na indústria de fundição da liga de alumínio, em que o silício é o único aditivo mais importante de alumínio para melhorar as suas propriedades de fundição. Uma vez que o alumínio fundido é amplamente utilizado na indústria automóvel, este uso de silício é, portanto, o único maior utilização industrial de "grau metalúrgico" de silício puro (como esta silício purificado é adicionado ao alumínio puro, ferro-silício enquanto que nunca é purificado antes de ser adicionado ao aço ).
Grau metalúrgico
Silício elementar não ligado com quantidades significativas de outros elementos, e, geralmente,> 95%, é muitas vezes referida como frouxamente silício metálico. Faz-se cerca de 20% da produção mundial total de silicone elementar, com menos do que 1 a 2% de silício elementar total (5-10% de silício de grau metalúrgico) já purificada para graus mais elevados para utilização em electrónica. Silício de grau metalúrgico é comercialmente preparados pela reacção de elevada pureza de sílica com madeira, carvão vegetal, carvão e numa forno elétrico a arco utilizando carbono eletrodos. A temperaturas superiores a 1900 ° C (3450 ° F), o carbono nos materiais acima mencionados e o silício submeter a reacção química SiO2 + 2 C → Si + 2 CO silício líquido. recolhe no fundo do forno, o qual é então drenado e arrefecido. O silício produzido desta maneira é chamado de silício de grau metalúrgico e é pelo menos 98% puro. Usando este método, carboneto de silício (SiC), também pode formar a partir de um excesso de carbono em uma ou ambas das seguintes maneiras:. SiO2 + C → SiO + CO ou SiO 2 + C + CO → SiC No entanto, desde que a concentração de SiO2 é mantido elevada, o carboneto de silício pode ser eliminado por meio da reacção química 2 SiC + SiO2 → 3 Si + 2 CO.
Como observado acima, silício de grau metalúrgico "metal" tem o seu uso primário na indústria de fundição de alumínio para fazer peças de liga de alumínio-silício. O restante (cerca de 45%) é utilizado pela a indústria química, onde é principalmente utilizado para fazer sílica coloidal pirogenada.
Em setembro de 2008, metalúrgicos custos de silício grau cerca de US $ 1,45 por libra (3,20 dólares / kg), acima dos US $ 0,77 por libra (1,70 dólares / kg) em 2005.
Eletrônica grau
O uso de silicone em semicondutores dispositivos exige uma muito maior pureza do que conferida pelo silício de grau metalúrgico. Muito silício puro (> 99,9%) pode ser extraída directamente de sílica sólida ou outros compostos de silício por electrólise de sal fundido. Este método, conhecido como cedo como 1854 (ver igualmente FFC processo de Cambridge), tem o potencial para produzir directamente silício de grau solar sem qualquer dióxido de carbono das emissões em muito menor consumo de energia.
Silício de grau solar não pode ser usado para semicondutores, onde a pureza deve ser extremo para controlar adequadamente o processo. Bolachas de silício em massa utilizados no início do processo de fabricação de circuito integrado tem de primeiro ser refinado para "nove noves" pureza (99.9999999%), um processo que requer repetidas aplicações de tecnologia de refinação.
A maioria dos cristais de silício crescido para a produção de dispositivo são produzidos pela Processo Czochralski, (CZ-Si), uma vez que é o método mais barato e disponível que seja capaz de produzir grandes cristais de tamanho. No entanto, os cristais individuais cultivadas pelo processo Czochralski conter impurezas porque o cadinho que contém o material fundido, muitas vezes se dissolve. Historicamente, vários métodos têm sido utilizados para produzir ultra-silício de alta pureza.
Técnicas de purificação de silício precoce foram baseadas no facto de que, se o silício é derretido e re-solidificado, as últimas partes da massa a solidificar conter a maior parte das impurezas. O mais antigo método de purificação de silício, descrita pela primeira vez em 1919 e usado em uma base limitada para fazer radar componentes durante a II Guerra Mundial , envolveu esmagamento silício grau metalúrgico e, em seguida, dissolvendo parcialmente o pó de silício em um ácido. Quando esmagadas, o silício rompido, de modo que as regiões ricas em impureza mais fracas eram no exterior dos grãos resultantes de silício. Como resultado, o silício rico em impurezas foi o primeiro a ser dissolvida quando tratados com ácido, deixando para trás um produto mais puro.
Em zona de fusão, também chamada zona de refinação, o primeiro método de purificação de silício a ser amplamente usado industrialmente, hastes de silício de grau metalúrgico é aquecido para derreter a uma extremidade. Em seguida, o aquecedor é lentamente movida ao longo do comprimento da haste, mantendo um pequeno comprimento dos fundido haste como o silício arrefece e re-solidifica por trás dele. Uma vez que a maioria das impurezas tendem a permanecer na região fundido em vez de re-solidificar, quando o processo está completo, a maior parte das impurezas na haste irá ter sido movido para a extremidade que foi o último a ser fundido. Esta extremidade é então cortada e eliminada, e o processo é repetido, se um grau de pureza ainda mais elevada é desejada.
Ao mesmo tempo, DuPont de silício produzido de ultra-puro por reacção com tetracloreto de silício de elevada pureza de zinco vapores a 950 ° C, a produção de silício de SiCl 4 + 2 Zn + 2 → Si ZnCl2. No entanto, esta técnica foi atormentado com problemas práticos (como o cloreto de zinco subproduto solidificação e linhas de entupimento) e acabou por ser abandonado em favor do processo Siemens . No processo da Siemens, barras de silício de elevada pureza são expostos a triclorossilano a 1150 ° C. O gás trichlorosilane decompõe e depósitos de silício adicional nas hastes, ampliando-los porque HSiCl 2 3 → Si + 2 + HCl SiCl4. Silicon produzido a partir desta e de processos semelhantes é chamado silício policristalino. Silício policristalino tem tipicamente níveis de impureza de menos de uma parte por bilhão.
Em 2006 REC anunciou a construção de uma planta com base em de leito fluidizado (FB) usando tecnologia de silano: 3 SiCl 4 + Si + 2 H 2 → 4 HSiCl 3, 4 HSiCl 3 → 3SiCl 4 + SiH4, SiH 4 → Si + 2 H 2. A vantagem da tecnologia de leito fluidizado é que os processos podem ser executados continuamente, obtendo-se rendimentos mais elevados do que os do processo da Siemens, que é um processo em descontínuo.
Hoje, o silício é purificado por conversão para um silício composto que pode ser mais facilmente purificado por destilação do que no seu estado original, e, em seguida, convertendo o composto de silício para trás em silício puro. Triclorosilano é o composto de silício mais vulgarmente utilizado como o intermediário, embora e tetracloreto de silício silano são também utilizados. Quando estes gases são sopradas sobre silício a alta temperatura, que se decompõem a elevada pureza de silício.
Além disso, há a Schumacher processo, que utiliza tribromosilane no lugar de trichlorosilane e tecnologia de leito fluidizado. Ele requer temperaturas mais baixas de deposição, menores custos de capital para construir e operar as instalações, não há polímeros perigosos nem material explosivo, e não produz resíduos de pó de silício amorfo, todas as quais são inconvenientes do processo da Siemens. No entanto, ainda há para ser qualquer grandes fábricas construídas usando este processo.
Compostos
- Silicon forma compostos chamados binários silicietos com diversos elementos metálicos cujas propriedades variam a partir de compostos reactivos, por exemplo, silicieto de magnésio, Mg 2 Si através de compostos refractários de fusão elevado, tais como disilicide molibdênio, MoSi 2.
- Carboneto de silício, SiC (carborundum) é um duro, alta sólida fusão e um bem conhecido abrasivo. Ele também pode ser sinterizado em um tipo de cerâmica de alta resistência utilizado na armadura.
- Silano, SiH4, é um gás pirofórico com uma estrutura semelhante a tetraédrica metano , CH4. Quando puro, que não reage com a água pura ou ácidos diluídos; No entanto, mesmo as pequenas quantidades de impurezas de metais alcalinos a partir do vidro de laboratório pode resultar numa hidrólise rápida. Há uma gama de hidretos de silício catenated que formam uma série homóloga de compostos, Si n H 2n onde n = 2-8 2 (análogo aos alcanos ). Estes são todos prontamente hidrolisado e são termicamente instável, em especial os membros mais pesados.
- Disilenes conter uma dupla ligação silício-silício (análogo aos alcenos ) e são geralmente altamente reactivo, que exige grandes grupos substituintes para estabilizá-los. A disilyne com a-silício silício ligação tripla foi isolado pela primeira vez em 2004; embora, como o composto é não-linear, a colagem é diferente daquela em alcinos.
- Tetra-halogenetos, SiX 4, são formadas com todos os halogéneos. O tetracloreto de silício, por exemplo, reage com a água, ao contrário do seu análogo de carbono, tetracloreto de carbono . Di-halogenetos de silício são formados pela reacção de alta temperatura e de tetra-halogenetos de silício; com uma estrutura análoga a um carbeno são compostos reactivos. Difluoreto de silício condensa-se para formar um composto polimérico, (2 SiF) n.
- O dióxido de silício é um sólido com um certo número de formas de cristal de fusão elevado; o mais conhecido dos quais é o mineral quartzo . Em quartzo cada átomo de silício está rodeado por quatro átomos de oxigénio que ligam a outros átomos de silício para formar uma rede tridimensional. A sílica é solúvel em água a altas temperaturas, formando uma gama de compostos chamados ácido monosilícico, Si (OH) 4.
- Sob as condições corretas ácido monosilícico prontamente polimeriza para formar ácido silícico mais complexos, que vão desde o mais simples condensado, ácido disilicic (H 6 Si 2 O 7) a linear, fita, camadas e estruturas treliçadas que formam a base dos muitos minerais de silicatos e são chamados ácidos polissilícicos {x Si (OH) 4-2x} n.
- Com os óxidos de outros elementos da reacção a temperatura elevada de dióxido de silício pode dar uma vasta gama de vidros com diversas propriedades. Exemplos incluem vidro soda cal, vidro de borosilicato e cristal de chumbo.
- Sulfeto de silício, SiS 2, é um sólido polimérico (ao contrário do seu análogo de carbono líquido CS 2).
- Silício constitui um nitreto, Si 3 N 4, que é um cerâmico. Silatranes, um grupo de compostos tricíclicos contendo cinco coordenadas de silício, podem ter propriedades fisiológicas.
- Muitos complexos de metais de transição contendo uma ligação metal-silício são agora conhecidos, que incluem complexos contendo SiH n X n 3- ligantes, seis três ligantes, e Si (OR) 3 ligantes.
- Os silicones são grande grupo de compostos poliméricos que apresentam (Si-O-Si) espinha dorsal. Um exemplo é o óleo de silicone PDMS (polidimetilsiloxano). Estes polímeros podem ser reticulados para produzir resinas e elastômeros.
- Muitos compostos orgânicos de silício são conhecidos, que contêm uma ligação silício-carbono simples. Muitos destes baseiam-se em um átomo de silício tetraédricos central, e alguns são centro opticamente activo quando existe quiralidade. Polímeros de cadeia longa contendo uma espinha dorsal de silício são conhecidos, tal como polydimethysilylene (SiMe2) n. Policarbosilano, [(SiMe 2) 2 CH 2] n com uma espinha dorsal que contém uma unidade de -Si-Si-C de repetição, é um precursor para a produção de fibras de carboneto de silício.
História
Foi chamada a atenção primeiro a sílica como o possível óxido de um direito fundamental elemento químico por Antoine Lavoisier , em 1787. Depois de uma tentativa de isolar silício em 1808, Sir Humphry Davy propôs o nome "silício" para o silício, do latim silex, para Silicis sílex, sílex, e adicionando o "ónio" terminando, porque ele acreditava que era um metal. Em 1811, Gay-Lussac e Thénard são pensados para ter impuro preparado de silício amorfo, através do aquecimento de, recentemente isolado de potássio com metais tetrafluoreto de silício, mas que não se purificar e caracterizar o produto, nem identificá-lo como um novo elemento. Silicon foi dado o seu nome actual em 1817 pelo químico escocês Thomas Thomson. Ele reteve parte do nome de Davy mas acrescentou que "-em" porque ele acreditava que o silício era um metalóide semelhante ao de boro e de carbono . Em 1823, Berzelius preparado de silício amorfo utilizando aproximadamente o mesmo método como Gay Lussac-(potássio metálico e silicofluoreto de potássio), mas purificando o produto de um pó castanho, lavando-o repetidas vezes. Como resultado, ele geralmente é dado o crédito para a descoberta do elemento.
Silício na sua forma cristalina mais comum não estava preparado até 31 anos depois, por Deville. Por electrólise impura de sódio - alumínio cloreto contendo aproximadamente 10% de silício, ele foi capaz de obter um ligeiramente impuro allotrope de silício em 1854. Mais tarde, mais métodos rentáveis têm sido desenvolvidos para isolar silício em vários allotrope formas, sendo a mais recente silicene.
Como o silício é um elemento importante em semicondutores e dispositivos de alta tecnologia, muitos lugares no mundo ostentar o seu nome. Por exemplo, Silicon Valley na Califórnia , uma vez que é a base para uma série de indústrias relacionadas com a tecnologia, leva o nome de silício. Outras localidades geográficas com conexões para a indústria já foram nomeados após o silício também. Exemplos incluem Silicon Floresta em Oregon , Silicon Hills em Austin, Texas, Silicon Saxony em Alemanha , o Vale do Silício na Índia , Silicon Border em Mexicali, México, Silicon Fen em Cambridge, Inglaterra , Silicon Roundabout em Londres , Silicon Glen na Escócia , e Silicon Gorge em Bristol, Inglaterra .
Aplicações
Compostos
Mais de silício é utilizado industrialmente sem serem separadas no elemento, e de facto muitas vezes com relativamente pouco processamento de ocorrência natural. Mais de 90% da crosta terrestre é composta por minerais de silicatos. Muitos destes têm usos comerciais diretos, tais como argilas, areia de sílica ea maioria dos tipos de construção de pedra. Assim, a grande maioria dos usos para silício são os compostos estruturais, quer como os minerais de silicato ou de sílica (dióxido de silício em bruto). Por exemplo, a sílica é uma parte importante do tijolo de cerâmica. Os silicatos são utilizados no fabrico de cimento Portland, que é utilizado em construção e argamassa de estuque, mas mais importante ainda combinado com areia de sílica, e cascalho (geralmente contendo minerais de silicatos, como granito), para fazer o betão que constitui a base da maior parte da muito maior industrial projetos de construção do mundo moderno.
Silicatos minerais também estão em cerâmicas de mesa, uma classe importante de produtos que contêm geralmente vários tipos de argila cozida (silicato de alumínio natural). Um exemplo é a porcelana que é baseado no mineral de silicato caulinita. Cerâmica incluem objetos de arte, e, produtos industriais e de construção no mercado interno. Vidro de soda-cal tradicional à base de quartzo, também funciona em muitas das mesmas funções.
Compostos de silício mais modernos também funcionam como abrasivos de alta tecnologia e novas cerâmicas de alta resistência com base em ( carboneto de silício), e em superligas.
Alternando cadeias de silício-oxigénio com hidrogénio ligado a silício a ligações restantes formar os materiais poliméricos à base de silício ubíquos conhecidos como silicones. Estes compostos que contêm silício-oxigénio e ocasionalmente ligações silício-carbono têm a capacidade de agir como intermediários de ligação entre o vidro e os compostos orgânicos, e para formar polímeros com propriedades úteis, tais como a impermeabilidade à água, flexibilidade e resistência ao ataque químico. Os silicones são frequentemente utilizados em tratamentos de impermeabilização, compostos de moldagem, mold- Os agentes de libertação, selos mecânicos, temperatura elevada graxas e ceras, e compostos de calafetagem. De silicone também é por vezes utilizado na implantes mamários, lentes de contato, explosivos e pirotecnia. Silly Putty foi originalmente feita pela adição de ácido bórico para óleo de silicone.
Alloys
Silício elementar é adicionado para fundir ferro fundido como ou ligas de ferro-silício silicocalcium para melhorar o desempenho em fundição secções finas e para evitar a formação de cementinta onde exposto ao ar exterior. A presença de silício elementar em atos de ferro fundido como um dissipador para o oxigénio, de modo que o teor de aços de carbono, que deve ser mantido dentro dos limites estreitos para cada tipo de aço, pode ser mais estreitamente controlada. Produção de ferro-silício e uso é um monitor da indústria siderúrgica, e embora esta forma de silício elementar é impuro, é responsável por 80% do consumo mundial de silício livre.
As propriedades do próprio silício pode ser usado para modificar as ligas. Importância do silício na fundição de alumínio é que uma quantidade significativamente alta (12%) de silício em alumínio forma uma mistura eutética que solidifica com muito pouca contracção térmica. Isso reduz muito lacrimejamento e fissuras formadas a partir de estresse como as ligas de arrefecer à solidez. Silício também melhora significativamente a dureza e resistência ao desgaste, assim, de alumínio. O silício é um componente importante da aço elétrico, modificando a sua resistividade e propriedades ferromagnéticas.
Silício de grau metalúrgico é o silício de 95-99% de pureza. Cerca de 55% do consumo mundial de silício metalúrgico pureza vai para a produção de ligas de alumínio-silício por parte de alumínio lança, principalmente para uso na indústria automotiva. A razão para a utilização de silício de alta nestas ligas é referido acima. A maior parte do resto do silício de grau metalúrgico é utilizada pela indústria química para a produção do produto industrial importante sílica coloidal pirogenada. O restante é usado na produção de outros produtos químicos finos, tais como silanos e alguns tipos de silicones.
Eletrônica
Desde silício mais elementar produzido permanece como liga de ferro-silício, apenas uma quantidade relativamente pequena (20%) do silício elementar produzido é refinado para pureza metalúrgico grau (um total de 1,3-1.500.000 toneladas / ano). A fracção de silício metálico, que é ainda mais refinado com a pureza de semicondutor é estimada em apenas 15% da produção mundial de silício de grau metalúrgico. No entanto, a importância económica do presente pequena fração muito alta pureza (especialmente o ~ 5%, o que é processada para silício monocristalino para uso em circuitos integrados) é desproporcionalmente grande.
Puro silício monocristalino é usado para produzir silício pastilhas usadas na indústria de semicondutores, em eletrônica e em alguns high-cost e de alta eficiência aplicações fotovoltaicas. Em termos de condução de carga, silício puro é um semicondutor intrínseco que significa que ao contrário dos metais que realiza buracos de elétrons e elétrons que possam ser liberados a partir de átomos dentro do cristal pelo calor, e assim aumentar silício de condutividade eléctrica com temperaturas mais elevadas. Silício puro tem uma condutividade muito baixa (ou seja, demasiado elevado resistividade) para ser utilizado como um elemento de circuito em electrónica. Na prática, o silício puro dopado com pequenas concentrações de certos outros elementos, um processo que aumenta significativamente a sua condutividade e ajusta a sua resposta eléctrica por meio do controle do número e da carga ( positiva ou negativa ) de portadoras activadas. Tal controle é necessário para transistores, células solares, detectores semicondutores e outros dispositivos semicondutores , que são utilizados na indústria de computadores e outras aplicações técnicas. Por exemplo, em fotónica de silício, silício pode ser usado como uma onda contínua Meio de laser de Raman para produzir luz coerente, no entanto é ineficaz como uma fonte de luz diárias.
Em comum de circuitos integrados , uma bolacha de silício monocristalino serve como um suporte mecânico para os circuitos, que são criados por dopagem, e isolados um do outro por camadas finas de óxido de silício , um isolador que é facilmente produzida através da exposição do elemento de oxigénio sob as condições adequadas. Silicon se tornou o material mais popular para construir ambos os semicondutores de alta potência e circuitos integrados. A razão é que o silício é o semicondutor que pode suportar as temperaturas mais elevadas e rede eléctrica, sem se tornar disfuncional devido repartição avalanche (um processo em que um avalanche de electrões é criado por um processo de reacção em cadeia pelo que o calor produz electrões e lacunas livres, que por sua vez produzem mais corrente que produz mais calor). Além disso, o óxido de silício isolante não é solúvel em água, o que lhe confere uma vantagem sobre germânio (um elemento com propriedades semelhantes que também podem ser utilizados em dispositivos semicondutores) em certo tipo de técnicas de fabricação.
Silício monocristalino é caro para produzir, e normalmente só é justificada na produção de circuitos integrados, onde imperfeições do cristal minúsculos podem interferir com pequenos caminhos de circuito. Para outras utilizações, podem ser empregues outros tipos de silício puro que não existem na forma de cristais individuais. Estes incluem de silício amorfo hidrogenado e actualizado de silício de grau metalúrgico (UMG-Si), que são utilizados na produção de baixo custo, eletrônica da grande-área em aplicações como ecrãs de cristais líquidos, e da grande-área, de baixo custo, de película fina células solares. Tais tipos de semicondutores de silício, que são ou ligeiramente menos puros do que os usados em circuitos integrados, ou que são produzidos em policristalino em vez de forma monocristalina, tornar-se quantidade aproximadamente similar de silício como são produzidos para a indústria de semicondutores de silício monocristalino, ou 75.000 a 150.000 toneladas métricas por ano. No entanto, a produção de tais materiais está a crescer mais rapidamente do que o silício para o mercado de circuito integrado. Em 2013 a produção de silício policristalino, usado principalmente em células solares, está projetada para atingir 200.000 toneladas métricas por ano, enquanto a produção de silício semicondutor monocristalino (usados em microchips de computador) permanece abaixo de 50 mil toneladas / ano.
Papel biológico
Embora o silício é prontamente disponíveis sob a forma de silicatos, muito poucos organismos têm um uso para ele. Diatomáceas, radiolaria e esponjas siliciosos usar sílica biogênica como material estrutural para a construção de esqueletos. Em plantas mais avançada, a sílica phytoliths Phytoliths (opala) são organismos microscópicos rígidas que ocorrem na célula; algumas plantas, por exemplo, arroz , precisa de silício para o seu crescimento. Apesar de silicone foi proposto para ser um traço de nutrientes ultra, sua função exata na biologia dos animais que ainda está em discussão. Organismos superiores são conhecidos apenas para usá-lo em ocasiões muito limitadas na forma de ácido silícico e silicatos solúveis.
O silício é conhecido por ser necessário para a síntese de e elastina colagénio; o aorta contém a maior quantidade de elastina e de silício.
Silicon está atualmente sob consideração para elevação ao status de "plantar substância benéfica pela Association of American Plant Food Controle Funcionários (AAPFCO)." O silício tem sido demonstrado em estudos universitários e de campo para melhorar a planta resistência da parede celular e integridade estrutural, melhorar a seca ea geada resistência, diminuir o potencial hospedagem e impulsionar natural de pragas e doenças sistemas de combate da planta. Silício também foi mostrado para melhorar o vigor da planta e fisiologia, melhorando a massa da raiz e densidade, e aumentar a biomassa da planta acima do solo e o rendimento das culturas.
Formas de vida baseadas em silício hipotéticos são objecto de bioquímica silício, por analogia com carbono baseados em formas de vida. Silício, ficando abaixo do carbono na tabela periódica, é pensado para ter propriedades semelhantes o suficiente para que tornariam a vida baseada em silício possível, mas muito diferente da vida como a conhecemos.