
Escândio
Fundo para as escolas Wikipédia
Arranjar uma seleção Wikipedia para as escolas no mundo em desenvolvimento sem internet foi uma iniciativa da SOS Children. Visite o site da SOS Children at http://www.soschildren.org/
| Escândio | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
21 Sc | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | ||||||||||||||||||||||||||||||||||||||||||||||||||||
branco prateado  | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | escândio, Sc, 21 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / s k æ n d Eu ə m / SKAN -dee-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria elemento | de metal de transição | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | 3, 4, d | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | 44.955912 (6) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Ar ] 3d 1 4s 2 2, 8, 9, 2 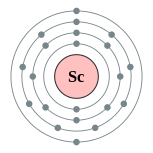 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| História | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Predição | Dmitri Mendeleev (1871) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Descoberta | Lars Fredrik Nilson (1879) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Primeiro isolamento | Lars Fredrik Nilson (1879) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 2,985 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidade no pf | 2,80 g cm -3 · | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 1814 K , 1541 ° C, 2806 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 3109 K, 2836 ° C, 5136 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusão | 14,1 kJ mol -1 · | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporização | 332,7 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 25.52 J · · mol -1 K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 3, 2, 1 (Óxido anfotérico) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 1,36 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização ( Mais) | 1º: 633,1 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 2: 1235,0 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3: 2388,6 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atômico | 162 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 170 ± 19:00 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals raio | 211 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | hexagonal repleto de perto | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | paramagnético | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistividade elétrica | ( RT) (α, poli) cale. 562 Nco · m | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 15,8 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Expansão térmica | ( RT) (α, poli) 10,2 mm / (m · K) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| O módulo de Young | 74,4 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de cisalhamento | 29,1 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa de módulo | 56,6 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Rácio de Poisson | 0,279 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 750 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-20-2 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de escândio | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
Scandium é um elemento químico com o símbolo Sc e número atômico 21. Um metálico branco prateado de metal de transição , que historicamente tem sido por vezes classificado como um elemento de terras raras, em conjunto com ítrio e os lantanídeos . Foi descoberto em 1879 por análise espectral dos minerais euxenite e gadolinite de Escandinávia.
Scandium está presente na maioria dos depósitos de terras raras e urânio compostos, mas é extraída a partir desses minérios em apenas algumas minas em todo o mundo. Devido à baixa disponibilidade e as dificuldades na preparação de escândio metálico, o que foi feito pela primeira vez em 1937, que levou até os anos 1970 antes foram desenvolvidos para aplicações de escândio. Os efeitos positivos de escândio em alumínio ligas foram descobertos na década de 1970, e seu uso em tais ligas continua sua única aplicação maior. O comércio global do metal puro é de cerca de uma centena de libras por ano, em média.
As propriedades dos compostos escândio são intermediários entre aqueles de alumínio e ítrio. A existe relação diagonal entre o comportamento de magnésio e escândio, assim como existe entre berílio e alumínio. Nos compostos químicos dos elementos mostrados no grupo 3, acima, o estado de oxidação +3 é predominante.
Propriedades
Características químicas do elemento
Scandium é um metal macio com uma aparência prateada. Desenvolve-se um elenco ligeiramente amarelado ou rosado quando oxidados por via aérea. É suscetível a intempéries e se dissolve lentamente na maioria dos ácidos diluídos. Ele não reage com uma mistura 1: 1 de ácido nítrico (HNO3) e ácido fluorídrico (HF), possivelmente devido à formação de um revestimento impermeável camada passiva.
Isótopos
Escândio existe naturalmente exclusivamente como o isótopo 45 SC, o qual tem um spin nuclear de 7/2. Treze radioisótopos foram caracterizados com os mais estáveis Sc 46 com uma meia-vida de 83,8 dias, 47 Sc, com uma semi-vida de 3,35 dias e 48 Sc, com uma semi-vida de 43,7 horas. Todos os restantes Os isótopos radioactivos têm semi-vidas que são menos do que 4 horas, e a maioria destes com meias-vidas de menos de 2 minutos. Este elemento também tem cinco meta estados com o Sc ser 44m mais estável (t ½ = 58,6 h).
Os isótopos de escândio faixa de 36 a 60 Sc Sc. O primário modo de decaimento em massas mais baixas do que o único isótopo estável, 45 Sc, é a captura eletrônica, eo primeiro modo em massas acima é a emissão beta. O primário produtos de decaimento em pesos atômicos abaixo de 45 Sc são cálcio isótopos e os produtos primários de pesos atômicos mais altos são de titânio isótopos.
Ocorrência
Em termos de crosta terrestre, escândio não é particularmente rara. As estimativas variam de 18 a 25 ppm, o que é comparável à abundância de cobalto (20-30 ppm). Scandium é apenas o elemento mais comum na Terra 50 (35 mais abundante na crosta), mas é o 23º elemento mais comum no Sun . No entanto, escândio é distribuído esparsamente e ocorre em pequenas quantidades em muitos minerais . Minerais raros da Escandinávia e Madagascar como thortveitite, euxenita, e gadolinite são as fontes concentradas conhecidas somente desse elemento. Thortveitite pode conter até 45% de escândio, sob a forma de escândio óxido (III).
A forma estável de escândio é criado em supernovas via processo-r.
Produção
A produção mundial de escândio é da ordem de 2 toneladas por ano na forma de óxido de escândio. A produção primária é de 400 kg, enquanto o resto é de arsenais de Rússia gerados durante a Guerra Fria . Em 2003, apenas três minas produziram escândio: as minas de urânio e ferro em Zhovti Vody na Ucrânia , as minas de terras raras na Bayan Obo, China e as minas de apatita no Península de Kola, Rússia . Em cada caso, escândio é um subproduto da extracção de outros elementos e é vendido como óxido de escândio.
A produção de escândio metálico é da ordem de 10 kg por ano. O óxido é convertido escândio e fluoreto reduzido com metálico cálcio .
Madagascar e Iveland- Evje região na Noruega têm os únicos depósitos de minerais com alto teor de escândio, thortveitite (Sc, Y) 2 (Si 2 O 7) e kolbeckite Scpo · 4 2H 2 O, mas estes não estão a ser exploradas.
A ausência de produção confiável, seguro, estável e de longo prazo tem limitado aplicações comerciais de escândio. Apesar deste baixo nível de uso, escândio oferece benefícios significativos. Particularmente promissor é o fortalecimento de ligas de alumínio com tão pouco como 0,5% escândio. Zircónia estabilizada-escândio goza de uma crescente procura do mercado para utilização como um electrólito de elevada eficiência em células de combustível de óxido sólido.
Compostos
A química é quase completamente dominado pelo ião trivalente, Sc 3+. Os raios de iões M 3+ na tabela abaixo indicam que, em termos de propriedades químicas, escândio iões são mais semelhantes às de ítrio do que para os de alumínio. Em parte por essa semelhança, escândio é muitas vezes classificado como um elemento lantanídeo-like.
Óxidos e hidróxidos
O óxido de Sc 2 O 3 e o hidróxido de Sc (OH) 3 são amphoteric:
- Sc (OH) 3 + 3 OH - → Sc (OH) 3-
6 - Sc (OH) 3 + 3 + 3 H + H2O → [Sc (H2O) 6] 3+
As formas α- e γ- de hidróxido de óxido de escândio (SCO (OH)), são isoestrutural com a sua homólogos de hidróxido de óxido de alumínio. Soluções de Sc 3+ na água são ácidos por causa de hidrólise.
Haletos e pseudo-
O halogenetos SCX 3 (X = Cl, Br, I), são muito solúveis em água, mas SCF 3 é insolúvel. Em todos os quatro halogenetos o escândio é 6-coordenada. Os halogenetos são Ácidos de Lewis; por exemplo, SCF 3 dissolve-se uma solução contendo o excesso de fluoreto para formar [SCF 6] 3-. O número de coordenação 6 é típico de Sc (III). Nos maiores Y 3+ e La 3+, números de coordenação de 8 e 9 são comuns. Scandium (III) triflato é usado às vezes como um Catalisador de ácido de Lewis em química orgânica .
Derivados orgânicos
Escândio forma uma série de compostos organometálicos com ligandos de ciclopentadienilo (Cp), semelhante ao comportamento dos lantanídeos. Um exemplo é o dímero com ponte de cloro, [SCCP 2 Cl] 2 e de derivados relacionados ligantes pentametilciclopentadienil.
Estados de oxidação pouco frequentes
Os compostos que apresentam escândio no estado de oxidação diferente do 3 são raras, mas bem caracterizado. O composto azul-preto CsScCl 3 é um dos mais simples. Este material adopta uma estrutura semelhante a uma folha que apresenta extensa ligação entre os centros de escândio (II). Escândio hidreto não é bem compreendida, embora não parece ser um hidreto de solução salina de Sc (II). Tal como é observado para a maioria dos elementos, um hidreto de escândio diatómico foi observada espectroscopicamente a temperaturas elevadas na fase gasosa. Boretos e carbonetos são escândio não estequiométrica, como é típico para os elementos vizinhos.
História
Dmitri Mendeleev , o criador da tabela periódica , previu a existência de um elemento ekaboron, com um massa atómica entre 40 e 48 em 1869. Lars Fredrik Nilson e sua equipe detectado este elemento nos minerais euxenite e gadolinite. Nilson preparado de 2 gramas óxido de escândio de alta pureza. Ele nomeou o escândio elemento, a partir do latim Scandia que significa "Escandinávia". Nilson estava aparentemente inconsciente de previsão de Mendeleev, mas Per Teodor Cleve reconheceu a correspondência e notificado Mendeleev.
Escândio metálico foi produzido pela primeira vez em 1937 por electrólise de uma mistura eutéctica, a 700-800 ° C , de potássio , de lítio , e cloretos de escândio. A primeira libra de 99% escândio metal puro foi produzido em 1960. O uso de ligas de alumínio começou em 1971, na sequência de uma patente nos EUA. Ligas de alumínio-escândio também foram desenvolvidos na URSS .
Cristais de laser de gadolínio-escândio-gálio granada (GSGG) foram utilizados em aplicações de defesa estratégicos desenvolvidos no Iniciativa de Defesa Estratégica (SDI) na década de 1980 e 1990.
Aplicações

A adição de escândio ao alumínio limita o crescimento excessivo de grãos que ocorre na zona afectada pelo calor dos componentes de alumínio soldadas. Isto tem dois efeitos benéficos: o precipitado Al 3 Sc forma cristais mais pequenos que são formados na outra ligas de alumínio e o volume de zonas livres de precipitado que normalmente existem nas fronteiras de grão de ligas de alumínio de endurecimento com a idade é reduzida. Ambos estes efeitos aumentam a utilidade da liga. No entanto, ligas de titânio, que são semelhantes em leveza e resistência, são mais baratos e muito mais amplamente utilizado.
A principal aplicação de escândio em peso está em ligas de alumínio-escândio para menores componentes da indústria aeroespacial. Estas ligas contêm entre 0,1% e 0,5% de escândio. Eles foram utilizados na aeronave militar russo, especificamente o MiG-21 e MiG-29.
Alguns itens de equipamentos esportivos, que dependem de materiais de alto desempenho, foram feitas com ligas de alumínio-escândio, incluindo bastões de beisebol, e de bicicletas quadros e componentes. Lacrosse também são feitas com ligas de escândio-titânio para tirar vantagem da força de titânio. A empresa de arma de fogo de fabricação americana Smith & Wesson revólveres produz com armação composta por liga de escândio e cilindros de titânio ou aço carbono.
Dentistas usam érbio, cromo: ítrio-escândio-gálio granada (Er, Cr: YSGG) lasers para a preparação da cavidade e em endodontia.
Aproximadamente 20 kg (como Sc 2 O 3) de escândio é usado anualmente nos Estados Unidos para fazer lâmpadas de descarga de alta intensidade. Iodeto de escândio, juntamente com iodeto de sódio, quando adicionado a uma forma modificada de lâmpada de vapor de mercúrio, produz uma forma de lâmpadas de iodetos metálicos. Esta lâmpada é uma fonte de luz branca com alta índice de reprodução de cor que se assemelha a luz solar suficiente para permitir uma boa reprodução de cores com TV câmeras. Cerca de 80 kg de escândio é usado em lâmpadas de iodetos metálicos / lâmpadas globalmente por ano. As primeiras lâmpadas de iodetos metálicos à base de escândio foram patenteados por General Electric e feito inicialmente na América do Norte, embora eles agora são produzidos em todos os principais países industrializados. O radioativo isótopo 46 Sc é usado em refinarias de petróleo como um agente de rastreamento. Escândio triflato é um catalítica Ácido de Lewis utilizado em química orgânica .
Saúde e segurança
Escândio elementar é considerado testes em animais não-tóxico e pouco de compostos escândio foi feito. O dose letal média (DL50) para os níveis de escândio (III) cloreto de ratos foram determinadas como 4 mg / kg de intraperitoneal e 755 mg / kg para administração oral. À luz destes resultados compostos de escândio deve ser manuseado como compostos de toxicidade moderada.
