
Disprósio
Você sabia ...
Crianças SOS têm produzido uma seleção de artigos da Wikipédia para escolas desde 2005. Patrocinadoras filhos ajuda as crianças no mundo em desenvolvimento para aprender também.
| Disprósio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
66 Dy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
branco prateado  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | disprósio, Dy, 66 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / d ɪ s p r oʊ z Eu ə m / dis- PROH -zee-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria Metallic | lantanídeos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | n / D, 6, f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | 162.500 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Xe ] 6s 4f 10 2 2, 8, 18, 28, 8, 2 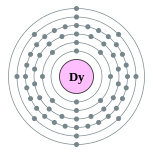 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| História | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descoberta | Lecoq de Boisbaudran (1886) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 8.540 g cm -3 · | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidade no pf | 8,37 g cm -3 · | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 1680 K , 1407 ° C, 2565 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 2840 K, 2562 ° C, 4653 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusão | 11,06 kJ mol -1 · | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporização | 280 kJ mol -1 · | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 27,7 J · · mol -1 K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 3, 2, 1 (Fracamente óxido de base) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 1,22 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização | 1º: 573,0 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Segunda: 1130 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3: 2200 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atômico | 178 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 192 ± 19:00 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | hexagonal repleto de perto | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | paramagnético a 300 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistividade elétrica | ( RT) (α, poli) 926 Nco · m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 10,7 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Expansão térmica | ( RT) (α, poli) 9,9 uM / (mK) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C) 2.710 m · s -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O módulo de Young | (Forma α) 61,4 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de cisalhamento | (Forma α) 24,7 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa de módulo | (Forma α) 40,5 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rácio de Poisson | (Forma α) 0,247 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Vickers | 540 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 500 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7429-91-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de disprósio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Disprósio é um elemento químico com o símbolo Dy e número atômico 66. É um terra-rara com um brilho prateado metálico. Disprósio nunca é encontrado na natureza como de um elemento livre, embora ela é encontrada em vários minerais, como o xenotime. De ocorrência natural disprósio é composto por 7 isótopos , o mais abundantes de que é 164 Dy.
Disprósio foi identificado pela primeira vez em 1886 por Paul Émile Lecoq de Boisbaudran, mas não foi isolado em forma pura, até o desenvolvimento de técnicas de troca iônica na década de 1950. Disprósio é usado pelo seu alto seção transversal de absorção de nêutrons térmicos em fazer barras de controle em reatores nucleares, por seu alto susceptibilidade magnética em aplicações de armazenamento de dados, e como um componente de Terfenol-D. Disprósio sais solúveis são ligeiramente tóxico, enquanto que os sais insolúveis são considerados não tóxicos.
Características
Propriedades físicas

Disprósio é um terra-rara que tem um metálico, brilho prateado brilhante. Ele é macio o suficiente para ser cortada com uma faca, e pode ser maquinada sem provocar sobreaquecimento, se for evitada. Características físicas do disprósio pode ser bastante afetada até mesmo por pequenas quantidades de impurezas.
Disprósio e hólmio têm as maiores forças magnéticas dos elementos, especialmente a baixas temperaturas. Disprósio tem um simples ordenação ferromagnético a temperaturas inferiores a 85 K (-188,2 ° C). Acima de 85 K (-188,2 ° C), ele se transforma em um helicoidal antiferromagnetic estado em que todos os momentos atómicos em um determinado plano basal camada são paralelas e orientadas em um ângulo fixo para os momentos de camadas adjacentes. Este antiferromagnetismo incomum transforma em uma desordenada ( paramagnética) estado em 179 K (-94 ° C).
Propriedades químicas
Disprósio de metal mancha lentamente no ar e queimaduras prontamente para formar disprósio (III), óxido de:
- 4 Dy + 3 O 2 → 2 Dy 2 O 3
Disprósio é bastante electropositive e reage lentamente com água fria e muito rapidamente com água quente para formar hidróxido de disprósio:
- 2 Dy (s) + 6 H2O (l) → 2 Dy (OH) 3 (aq) + 3H 2 (g)
Disprósio de metal reage vigorosamente com todos os halogéneos acima de 200 ° C:
- 2 Dy (s) + 3 F 2 (g) → 2 Dyf 3 (s) [verde]
- 2 Dy (s) + 3 Cl2 (g) → 2 DyCl 3 (s) [branco]
- 2 Dy (s) + 3 Br 2 (g) → 2 DyBr 3 (s) [branco]
- 2 Dy (s) + 3 I 2 (g) → 2 DYI 3 (s) [verde]
Disprósio se dissolve facilmente em diluída de ácido sulfúrico para formar soluções contendo o Dy amarelo (III) íons, que existem como um [Dy (OH 2) 9] 3+ complexos:
- 2 Dy (s) + 3 H 2 SO 4 (aq) → 2 Dy 3+ (aq) + SO 3 2-
4 (aq) + 3H 2 (g)
Compostos

Halogenetos de disprósio, como Dyf 3 e DyBr 3, tendem a assumir uma cor amarela. Óxido de disprósio, também conhecido como dysprosia, é um pó branco que é altamente magnético , mais do que o óxido de ferro.
Disprósio combina com vários não-metais em altas temperaturas para formar compostos binários com diferentes composição e oxidação estados 3 e às vezes dois, como DyN, DYP, DYH 2 e 3 DYH; DyS, DyS 2, Dy 2 S 3 e S Dy 5 7; DYB 2, DYB 4, 6 e DYB DYB 12, bem como Dy 3 C 2 e C 3 Dy.
Carbonato de disprósio, Dy 2 (CO3) 3, e sulfato de disprósio, Dy 2 (SO 4) 3, resultar de reacções semelhantes. A maioria dos compostos disprósio são solúveis em água, embora o carbonato de tetra-disprósio (Dy 2 (CO 3) 3 · 4H 2 O) e deca-hidrato de oxalato de disprósio (Dy 2 (C 2 O 4) 3 · 10H 2 O) são ambos insolúvel em água.
Isótopos
Naturalmente que ocorre disprósio é composto por 7 isótopos : 156 Dy, 158 Dy, 160 Dy, 161 Dy, 162 Dy, 163 Dy, e 164 Dy. Estes são todos considerados estáveis, embora 156 Dy decai por decaimento alfa com uma meia-vida de mais de 1 × 10 18 anos. Dos isótopos naturais, 164 Dy é o mais abundante em 28%, seguido por 162 Dy em 26%. A menos abundante é 156 Dy em 0,06%.
Vinte e nove radioisótopos também foram sintetizados, que variam em massa atómica de 138 a 173. A maioria destes é estável 154 Dy com uma meia-vida de aproximadamente 3 x 10 6 anos, seguido por 159 Dy com uma meia-vida de 144,4 dias. A menos estável é 138 Dy com uma meia-vida de 200 ms. Isótopos que são mais leves do que os isótopos estáveis tendem a decair principalmente por β + decadência, enquanto que aqueles que são mais pesados tendem a decair por β -. decadência, com algumas exceções 154 Dy decai principalmente pelo decaimento alfa, e 152 Dy e 159 decadência Dy principalmente por captura de elétrons. Disprósio também tem, pelo menos, 11 isómeros metaestáveis, que variam em massa atómica de 140 a 165. A maioria destes é estável 165m Dy, que tem uma meia-vida de 1,257 minutos. 149 Dy tem dois isómeros metaestáveis, a segunda das quais, 149m2 Dy, tem uma semi- vida de 28 ns.
História
Em 1878, érbio minérios foram encontrados para conter os óxidos de hólmio e de túlio . Químico francês Paul Émile Lecoq de Boisbaudran, ao trabalhar com óxido de hólmio, separados óxido de disprósio dele em Paris em 1886. Seu procedimento para isolar o disprósio envolvido dissolvendo óxido de disprósio em ácido, em seguida, adicionando amoníaco para precipitar o hidróxido. Ele só foi capaz de isolar disprósio de seu óxido após mais de 30 tentativas de seu procedimento. Após o sucesso, ele nomeou o disprósio elemento dos dysprositos gregos (δυσπρόσιτος), que significa "difícil de obter". No entanto, o elemento não foi isolado na forma relativamente pura até depois do desenvolvimento de técnicas de permuta de iões por Frank Spedding em Iowa State University, no início de 1950.
Em 1950, Glenn T. Seaborg, Albert Ghiorso, e Stanley G. Thompson bombardeados 241 Am com íons de hélio, que produziram átomos com um número atômico de 97 e que apresenta grande semelhança com a dos lantanídeos vizinha térbio . Porque térbio foi nomeado após Ytterby, a cidade em que ele e vários outros elementos foram descobertos, este novo elemento foi nomeado berquélio para a cidade em que foi sintetizada. No entanto, quando a equipe de pesquisa elemento 98 sintetizado, que não conseguia pensar em uma boa analogia para disprósio e, em vez nomeado o elemento califórnio em homenagem ao estado em que foi sintetizada. A equipe de pesquisa foi sobre "apontam que, em reconhecimento do facto de disprósio é nomeado com base em uma palavra grega que significa" difícil de chegar, "que os pesquisadores para um outro elemento de um século atrás achava difícil chegar à Califórnia. "
Ocorrência

Disprósio nunca é encontrado como elemento livre, mas é encontrado em muitos minerais , incluindo xenotime, fergusonite, gadolinite, euxenite, polycrase, blomstrandine, monazita e bastnäsite; muitas vezes com érbio e holmium ou outros elementos de terras raras. Atualmente, a maioria disprósio está sendo obtido a partir dos minérios de argila ion-adsorção do sul da China, e as fontes futuras irão incluir a região de Halls Creek, na Austrália Ocidental. No alto ítrio versão destes, disprósio passa a ser o mais abundante dos pesados lantanídeos , compreendendo até 7-8% do concentrado (como comparado a cerca de 65% de ítrio). A concentração de Dy na crosta da Terra é de cerca de 5,2 mg / kg e em água do mar de 0,9 ng / L.
Produção
Disprósio é obtida principalmente a partir de areia monazítica, uma mistura de vários fosfatos. O metal é obtido como um produto de por na extracção comercial de ítrio. Ao isolar disprósio, a maior parte dos metais indesejados podem ser removidos por um ou magneticamente processo de flotação. Disprósio pode então ser separado de outros metais de terras raras, uma permuta iónica processo de deslocamento. Os íons de disprósio resultantes podem então reagir com ou flúor ou cloro para formar fluoreto de disprósio, Dyf 3, ou cloreto de disprósio, DyCl 3. Estes compostos podem ser reduzido utilizando metais ou de cálcio ou de lítio nas reacções seguintes:
- 3 Ca + 2 Dyf 3 → 2 Dy + 3 CaF2
- 3 Li + DyCl 3 → Dy + 3 LiCl
Os componentes são colocados num tântalo cadinho e aquecido num hélio atmosfera. À medida que a reacção progride, os compostos de halogeneto resultantes e disprósio fundido separar devido a diferenças na densidade. Quando a mistura arrefece, o disprósio pode ser cortada a partir das impurezas.
Cerca de 100 toneladas de disprósio são produzidos anualmente no mundo, com 99% do total produzido na China. Disprósio preços subiram quase vinte vezes, a partir de US $ 7 por libra em 2003, para US $ 130 por libra no final de 2010. De acordo com o Departamento de Energia dos Estados Unidos, a ampla gama de sua atual e projetada usos, juntamente com a falta de qualquer substituição imediatamente adequado, faz disprósio o elemento mais crítico para emergentes tecnologias de energia limpa - até mesmo suas projeções mais conservadoras prevêem um déficit de disprósio antes 2015.
Aplicações
Disprósio é usado, em conjunto com o vanádio e outros elementos, no sentido de tornar a laser e materiais de iluminação comercial. Por causa de disprósio de alta absorção de nêutrons térmicos de seção transversal, disprósio óxido de níquel- cermets são utilizados em barras de controle de absorção de nêutrons em reatores nucleares. Dysprosium- cádmio chalcogenides são fontes de radiação infravermelha que é útil para o estudo de reacções químicas. Porque disprósio e os seus compostos são altamente susceptíveis a magnetização, eles são utilizados em várias aplicações de armazenamento de dados, tais como em discos rígidos.
Neodímio -ferro-boro imans pode ter até 6% de neodímio substituído com o disprósio de aumentar o coercitividade para aplicações como motores de acionamento para veículos elétricos híbridos exigente. Esta substituição exigiria até 100 gramas de disprósio por carro híbrido produzido. Baseado em Projetadas 2 milhões de unidades da Toyota por ano, o uso de disprósio em aplicações como isso iria rapidamente esgotar a oferta disponível de metal. A substituição disprósio também podem ser úteis em outras aplicações, uma vez que melhora a resistência à corrosão dos magnetos.
Disprósio é um dos componentes de Terfenol-D, juntamente com ferro e térbio. Terfenol-D tem a maior temperatura ambiente magnetoestricção de qualquer material conhecido; esta propriedade é empregada em transdutores, de banda larga ressonadores mecânicos e de alta precisão injetores de combustível líquido.
Disprósio é usado em dosímetros para medir radiação ionizante. Cristais de sulfato de cálcio ou fluoreto de cálcio são dopados com disprósio. Quando esses cristais são expostos à radiação, os átomos de disprósio tornar animado e luminescente. A luminescência pode ser medido para determinar o grau de exposição ao qual o dosímetro foi submetido.
Nanofibras de compostos disprósio têm alta resistência e grande área de superfície; portanto, eles podem ser usados para o reforço de outros materiais e como um catalisador. Fibras de fluoreto de óxido de disprósio pode ser produzido por aquecimento de uma solução aquosa de DyBr 3 e NaF a 450 ° C a 450 bar de pressão durante 17 horas. Este material é extremamente robusta, sobrevivendo mais de 100 horas em várias soluções aquosas a temperaturas superiores a 400 ° C sem re-dissolução ou agregação.
Iodeto de disprósio e brometo de disprósio são usados na iluminação de alta intensidade. Estes compostos dissociar perto do centro quente da lâmpada liberando átomos de disprósio isoladas. A última luz re-emitem na parte verde e vermelha do espectro, assim, efetivamente produzindo luz brilhante.
Precauções
Como muitos pós, disprósio pó pode apresentar um perigo de explosão quando misturado com o ar e quando uma fonte de ignição está presente. Folhas finas da substância também pode ser inflamados por faíscas ou por electricidade estática. Incêndios disprósio não pode ser posto para fora por água. Ela pode reagir com água para produzir inflamável hidrogénio gás. Fogos de cloreto de disprósio, no entanto, pode ser extinto com água, enquanto fluoreto de disprósio e óxido de disprósio não são inflamáveis. Nitrato de disprósio, Dy (NO3) 3, é uma forte agente oxidante e se inflame facilmente quando em contato com substâncias orgânicas.
Sais de disprósio solúveis, tais como cloreto de disprósio e nitrato de disprósio, são ligeiramente tóxico quando ingerido. Os sais insolúveis, no entanto, não são tóxicos. Com base na toxicidade de cloreto de disprósio a ratinhos , estima-se que a ingestão de 500 gramas ou mais pode ser fatal para um ser humano.
