
Cádmio
Sobre este escolas selecção Wikipedia
Crianças SOS tentou tornar o conteúdo mais acessível Wikipedia por esta selecção escolas. Uma boa maneira de ajudar outras crianças é por patrocinar uma criança
| Cádmio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
48 Cd | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
prateado metálico cinza-azulado  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | cádmio, Cd, 48 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / k æ d m Eu ə m / KAD -mee-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria Metallic | de metal de transição Alternativamente considerado um metais de transição pós- | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | 12, 5, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | 112,411 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Kr ] 5s 2 4d 10 2, 8, 18, 18, 2 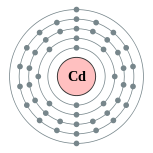 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| História | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descoberta | Karl Hermann Samuel Leberecht e Friedrich Stromeyer (1817) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primeiro isolamento | Karl Hermann Samuel Leberecht e Friedrich Stromeyer (1817) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nomeado por | Friedrich Stromeyer (1817) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 8,65 g cm -3 · | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidade no pf | 7.996 g cm -3 · | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 594,22 K , 321,07 ° C, 609,93 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 1,040 K, 767 ° C, 1413 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusão | 6.21 kJ mol -1 · | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporização | 99,87 kJ mol -1 · | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 26,020 J · · mol -1 K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 2, 1 (levemente óxido de base) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 1,69 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização | 1º: 867,8 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2: 1631,4 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3: 3616 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atômico | 151 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 144 ± 21:00 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals raio | 158 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | hexagonal repleto de perto | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | diamagnetic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistividade elétrica | (22 ° C) 72,7 Nco · m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 96,6 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Expansão térmica | (25 ° C) de 30,8 pM · · K -1 m -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C) 2.310 m · s -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O módulo de Young | 50 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de cisalhamento | 19 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa de módulo | 42 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rácio de Poisson | 0,30 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 2.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 203 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-43-9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de cádmio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
O cádmio é um elemento químico com o símbolo Cd e número atômico 48. Este metal macio, branco-azulado é quimicamente semelhante à dos dois outros metais estáveis grupo 12, zinco e mercúrio . Como zinco, prefere estado de oxidação +2 na maioria dos seus compostos e como o mercúrio que mostra um ponto de fusão baixo em comparação com os metais de transição . Cádmio e seus congêneres nem sempre são considerados metais de transição, em que eles não têm parcialmente cheio d ou f camadas eletrônicas nos estados de oxidação elementares ou comuns. A concentração média de cádmio na crosta da Terra é entre 0,1 e 0,5 partes por milhão (ppm). Ele foi descoberto em 1817 simultaneamente por Stromeyer e Hermann, tanto na Alemanha, como uma impureza em carbonato de zinco.
O cádmio ocorre como um componente menor na maioria dos minérios de zinco e, portanto, é um subproduto da produção de zinco. Foi usado durante muito tempo como um pigmento para revestimento e resistente à corrosão sobre aço , enquanto os compostos de cádmio foram usadas para estabilizar plástico . Com a excepção da sua utilização em baterias de níquel-cádmio e telureto de cádmio painéis solares, a utilização de cádmio é geralmente diminuindo. Estas descidas foram devido a tecnologias concorrentes, cádmio de toxicidade em certas formas e concentração e regulamentos resultantes. Embora o cádmio não tem função biológica conhecida em organismos superiores, dependente de cádmio-a anidrase carbónica foi encontrado na água do mar diatomáceas.
Características
Propriedades físicas
O cádmio é um pano macio, maleável, dúctil, branco-azulada divalente de metal . É semelhante em muitos aspectos ao zinco mas formas compostos complexos. Ao contrário de outros metais, o cádmio é resistente à corrosão e, como resultado, é usada como uma camada protectora, quando depositado sobre outros metais. Como metal a granel, o cádmio é insolúvel em água e não é inflamável; no entanto, na sua forma em pó pode queimar e liberar gases tóxicos.
Propriedades químicas
Embora cádmio tem geralmente um estado de oxidação de +2, que também existe no estado 1. Cádmio e seus congêneres nem sempre são considerados metais de transição, em que eles não têm parcialmente cheio d ou f camadas eletrônicas nos estados de oxidação elementares ou comuns. Cádmio queima no ar para formar marrom amorfo óxido de cádmio (CdO); o forma cristalina deste composto é um vermelho escuro, que muda de cor quando aquecida, semelhante ao óxido de zinco. ácido clorídrico , ácido sulfúrico e ácido nítrico dissolver através da formação de cádmio cloreto de cádmio (CdCl2), sulfato de cádmio (CDSO 4), ou nitrato de cádmio (Cd (NO3 2)). O estado de oxidação 1 pode ser alcançada por dissolução de cádmio numa mistura de cloreto de cádmio e cloreto de alumínio , formando a 2 Cd 2+ catião, o qual é semelhante ao Hg 2+ 2 catião em mercúrio (I), cloreto.
- Cd + 2 + CdCl2 AlCl3 → CD 2 (AlCl 4) 2
Isótopos

De ocorrência natural cádmio é composto por oito isótopos . Dois deles são naturalmente radioactivos, e espera-se que três decaimento mas não foram confirmados experimentalmente a fazê-lo. Os dois isótopos radioativos naturais são 113 Cd ( decaimento beta, meia-vida é de 7,7 × 10 15 anos) e 116 Cd (dois neutrino decaimento beta duplo, meia-vida é de 2,9 × 10 19 anos). Os outros três são 106 Cd, 108 Cd (tanto dupla captura de elétrons), e 114 Cd (decaimento beta duplo); limites única mais baixos em seus tempos de meia-vida foram definidas. Pelo menos três isótopos - 110 Cd, 111 Cd, e 112 Cd - são estáveis. Entre os isótopos que não ocorrem naturalmente, a mais longa vida são Cd 109 com uma meia-vida de 462,6 dias, e 115 CD com uma meia-vida de 53,46 horas. Todos os demais isótopos radioactivos têm semi-vidas de menos de 2,5 horas, e a maioria delas têm semi-vidas que são menos do que 5 minutos. O cádmio tem 8 conhecido meta estados, sendo os mais estáveis o 113m Cd (t ½ = 14,1 anos), 115m Cd (t ½ = 44,6 dias), e 117m Cd (t ½ = 3,36 horas).
Os isótopos conhecidos de gama em cádmio massa atômica de 94,950 u (95 CD) para 131,946 u (132 Cd). Para isótopos mais leves do que 112 u, o primárias modo de decaimento é captura eletrônica eo dominante produto de decaimento é elemento 47 ( prata ). Mais pesado isótopos decadência principalmente através de beta produtoras de emissão elemento 49 ( índio ).
Um isótopo de cádmio, 113 Cd, absorve nêutrons com probabilidade muito alta se eles têm uma energia abaixo do cádmio de corte e transmite-los do contrário. O cádmio de corte é de cerca de 0,5 eV. Nêutrons com energia abaixo do cut-off são considerados nêutrons lentos, distinguindo-os dos nêutrons intermediários e rápidos.
O cádmio é criado através do longo s processo em estrelas de massa baixa médios com massas de 0,6-10 massas solares , que dura milhares de anos. Ela exige uma prata átomo para capturar um nêutron e, em seguida, submetidos a decaimento beta.
História

Cádmio ( Latin cadmia, grego significado καδμεία " calamina ", uma mistura de cádmio-bearing de minerais, que foi nomeado após o personagem mitológico grego, Κάδμος Cadmus, fundador da Tebas) foi descobertas simultaneamente em 1817 por Friedrich e Stromeyer Karl Samuel Leberecht Hermann, tanto na Alemanha , como uma impureza em carbonato de zinco. Stromeyer encontrado o novo elemento como uma impureza no carbonato de zinco (calamina), e, por 100 anos, Alemanha permaneceu o único produtor importante do metal. O metal foi nomeado após a palavra latina para calamine, uma vez que o metal foi encontrado neste composto de zinco. Stromeyer observou que algumas amostras impuras de calamina mudou de cor quando calamina aquecida, mas pura não o fez. Ele foi persistente em estudar estes resultados e, eventualmente, isolado cádmio metálico por assar e redução do sulfeto. A possibilidade de utilização de cádmio como pigmento amarelo foi reconhecido na década de 1840, mas a falta de cádmio limitado desta aplicação.
Mesmo que o cádmio e os seus compostos podem ser tóxico em certas formas e concentrações, o Farmacêutica Britânica Codex de 1907 estados que iodeto de cádmio foi utilizado como um medicamentos para tratar "juntas alargada, glândulas escrofulosas e frieiras".
Em 1927, a Conferência Internacional de Pesos e Medidas redefiniu o metro em termos de uma linha espectral vermelho cádmio (1 m = 1,553,164.13 comprimentos de onda). Esta definição já foi alterado (ver criptônio ).
Após a produção em escala industrial de cádmio começou na década de 1930 e 1940, a maior aplicação de cádmio foi o revestimento de ferro e aço para evitar a corrosão; em 1944, 62% e, em 1956, 59% do cádmio nos Estados Unidos foi de revestimento. Em 1956, 24% do cádmio utilizado nos Estados Unidos foi usado para a segunda aplicação, que foi para pigmentos vermelhos, alaranjados e amarelos com base em sulfetos e selenetos de cádmio. O efeito estabilizador de produtos químicos contendo cádmio como o laureado carboxilatos cádmio e estearato de cádmio em PVC levou a um aumento da utilização desses compostos em 1970 e 1980. A utilização de cádmio em aplicações tais como pigmentos, tintas, estabilizadores e ligas diminuiu devido aos regulamentos ambientais e de saúde nos anos 1980 e 1990; em 2006, apenas 7% do consumo total de cádmio foi usada para revestimento e revestimento, e apenas 10% foi utilizado para pigmentos. A diminuição do consumo em outras aplicações era composta por uma demanda crescente de cádmio nas baterias de níquel-cádmio, que respondeu por 81% do consumo de cádmio nos Estados Unidos em 2006.
Ocorrência

Cádmio torna-se cerca de 0,1 ppm da crosta terrestre . Comparado com o mais abundante zinco 65 ppm, o cádmio é raro. Não há depósitos significativos de minérios contendo cádmio são conhecidos. Greenockite (Cd S ), a única cádmio mineral de importância, é quase sempre associado com sphalerite (ZnS). Esta associação é causada pela semelhança geoquímico entre o zinco e o cádmio, que torna pouco provável a separação geológica. Como consequência, o cádmio é produzido principalmente como subproduto da mineração, fundição e refino de minérios sulfidic de zinco, e, até certo ponto, menor lead e cobre . Pequenas quantidades de cádmio, cerca de 10% do consumo, são produzidos a partir de fontes secundárias, principalmente a partir de pó gerado através da reciclagem de sucata de ferro e aço. Produção nos Estados Unidos começou em 1907, mas não foi até depois da Primeira Guerra Mundial que o cádmio entrou em uso de largura. Um lugar onde cádmio metálico pode ser encontrado é o Bacia do Rio Vilyuy em Sibéria.
Rochas minadas para produzir adubos de fosfato contêm quantidades variáveis de cádmio, que conduz a uma concentração de cádmio até 300 mg / kg nos adubos de fosfato produzidos e, portanto, o elevado teor de cádmio em solos agrícolas. O carvão pode conter quantidades significativas de cádmio, o que acaba principalmente na escória de aciaria.
Produção
O British Geological Inquérito refere que, em 2001, a China foi o maior produtor de cádmio, produzindo quase um sexto da quota mundial, seguido de perto pela Coréia do Sul e Japão.
O cádmio é uma impureza comum em zinco minérios, e é mais freqüentemente isolado durante a produção de zinco. Alguns minérios de zinco concentrados de minérios de zinco sulfidic conter até 1,4% de cádmio. Em 1970, a saída de cádmio era de 6,5 libras por tonelada de zinco. Zinco minérios de sulfureto são torrados na presença de oxigénio , a conversão de sulfureto de zinco para a óxido. O zinco metálico é produzido quer por fusão do óxido de carbono ou por electrólise em ácido sulfúrico . O cádmio é isolado a partir do zinco metálico por destilação de vácuo, se o zinco é fundido, ou sulfato de cádmio é precipitou a partir da solução de electrólise.

Tendência a produção mundial

Saída de cádmio em 2005
Aplicações
O cádmio tem muitos usos industriais comuns, pois é um componente chave na produção de pilhas, está presente em pigmentos de cádmio, revestimentos, e é comumente usado em galvanoplastia.
Baterias

Em 2009, 86% de cádmio foi utilizado em baterias, predominantemente em recarregável baterias de níquel-cádmio. Células de níquel-cádmio têm um potencial de célula nominal de 1,2 V . A célula é constituída por uma positiva hidróxido de níquel e um eléctrodo de placa do eléctrodo negativo cádmio separados por uma alcalino electrólito ( hidróxido de potássio). A União Europeia proibiu a utilização de cádmio em eletrônica em 2004 com várias exceções, mas reduziu o teor permitido de cádmio em eletrônica para 0,002%.
Galvanoplastia

Cádmio galvanoplastia, consumindo 6% da produção mundial, pode ser encontrado na indústria aeronáutica devido à capacidade de resistir à corrosão quando aplicado a componentes de aço. Este revestimento é passivado pela utilização de sais de cromato. Uma limitação do chapeamento de cádmio é a hidrogenização de aços de alta resistência causado pelo processo de galvanização. Portanto, peças de aço tratado termicamente para resistência à tracção acima 1300 MPa (200 ksi) deve ser revestidos por um método alternativo (como os processos de electrodeposição de cádmio especiais de baixa fragilização ou deposição física de vapor). Além disso, a fragilização de titânio causada por resíduos de ferramentas cadmiados resultou em banimento dessas ferramentas (junto com programas de testes ferramenta de rotina para detectar qualquer contaminação de cádmio) a partir dos programas A-12 / SR-71 e U-2, e programas de aeronaves subsequentes usando titânio.
Fissão nuclear
O cádmio é utilizado como uma barreira para controlar neutrões em fissão nuclear . O reator de água pressurizada projetada por Westinghouse Electric Company utiliza uma liga que consiste em 80% de prata, 15% de índio, e 5% de cádmio.
Compostos

Óxido de cádmio é usado em fósforos de televisão a preto e branco e em que os fósforos azuis e verdes para tubos de imagem de televisão a cores. Sulfeto de cádmio (CdS) é usado como um revestimento de superfície photoconductive para tambores fotocopiadora.

Em pigmentos de tintas, cádmio faz vários sais , com CDs, sendo o mais comum. Este sulfureto é usado como um pigmento amarelo. Seleneto de cádmio pode ser usado como pigmento vermelho, vulgarmente chamado vermelho cádmio. Para os pintores que trabalham com o pigmento, amarelos, laranjas, cádmio e vermelhos são as cores mais brilhantes e duradouras para usar. De fato, durante a produção, essas cores são tonificados significativamente antes que eles são moídos com óleos e pastas, ou misturado em aquarelas , guaches, acrílicos, e outras formulações de tintas e pigmentos. Uma vez que estes pigmentos são potencialmente tóxico, é recomendado o uso de um creme barreira nas mãos para evitar a absorção através da pele quando se trabalha com eles, embora a quantidade de cádmio absorvido para dentro do corpo através da pele é geralmente relatado como sendo inferior a 1%.
Em PVC, cádmio foi usado como calor, luz e estabilizadores de intemperismo. Atualmente, estabilizantes de cádmio foram totalmente substituídos por bário-zinco, cálcio-zinco e estabilizadores de organo-estanho. O cádmio é utilizado em muitos tipos de solda e ligas de rolamento, devido a um baixo coeficiente de fricção e resistência à fadiga. Também é encontrada em alguns dos mais baixos de fusão ligas, tais como De metal de Wood.
Utilizações laboratoriais
Lasers de hélio-cádmio são uma fonte comum de azul-luz ultravioleta laser. Eles operam em cada 325 ou 422 nm e são utilizados em microscópios de fluorescência e vários experimentos de laboratório. Seleneto de cádmio pontos quânticos emitem brilhante luminescência sob excitação UV (laser He-Cd, por exemplo). A cor deste luminescência pode ser verde, amarela ou vermelha consoante o tamanho das partículas. As soluções coloidais de tais partículas são utilizados para imagiologia de tecidos biológicos e soluções com um microscópio de fluorescência.
O cádmio é um componente de alguns compostos semicondutores , tais como sulfureto de cádmio, seleneto de cádmio, e telureto de cádmio, que pode ser usado para a detecção ou luz células solares. HgCdTe é sensível às luz infravermelha e, por conseguinte, pode ser utilizada como um detector de infravermelhos ou interruptor, por exemplo, em dispositivos de controlo remoto.
Em biologia molecular, o cádmio é utilizado para bloquear os canais de cálcio dependentes da voltagem de fazendo fluir iões de cálcio, bem como em pesquisa hipóxia para estimular degradação dependente de proteassoma de HIF-1α.
Papel biológico
O cádmio não tem nenhum papel útil conhecida nos organismos superiores, mas uma cádmio-dependente anidrase carbónica foi encontrado em alguns marinho diatomáceas. As diatomáceas viver em ambientes com concentrações muito baixas de zinco e cádmio executa a função normalmente realizado por zinco em outros anidrases. A descoberta foi feita usando espectroscopia de raios-X de absorção de fluorescência (XAFS).
A concentração mais elevada de cádmio foi encontrado para ser absorvido nos rins dos seres humanos, e até cerca de 30 mg de cádmio é comumente inalado durante toda a infância e a adolescência.
O cádmio pode ser usado para bloquear os canais de cálcio em neurónios de frango.
Segurança
A forma mais perigosa de exposição ocupacional ao cádmio é a inalação de poeiras e fumos multa, ou ingestão de compostos de cádmio altamente solúveis. A inalação de fumos contendo cádmio pode resultar inicialmente na febre dos fumos metálicos, mas pode progredir para química pneumonite, edema pulmonar e morte.
O cádmio é também um perigo ambiental. Exposição humana ao cádmio ambiental são principalmente o resultado da combustão de combustíveis fósseis, fertilizantes fosfatados, fontes naturais, a produção de ferro e aço, produção de cimento e actividades conexas, produção de metais não-ferrosos, e incineração de resíduos sólidos urbanos. Pão, tubérculos, legumes e também contribuir para o cádmio em populações modernas. Tem havido alguns casos de toxicidade população em geral como resultado da exposição a longo prazo ao cádmio em alimentos e água contaminados, ea pesquisa está em curso em relação ao mimetismo estrogênio que pode induzir câncer de mama. Nas décadas que antecederam a Segunda Guerra Mundial , as operações de mineração japoneses contaminou o Rio Jinzū com cádmio e traços de outros metais tóxicos. Como consequência, o cádmio acumulado nos cultivos de arroz que crescem ao longo das margens dos rios a jusante das minas. Alguns membros das comunidades agrícolas locais que consomem o arroz contaminado desenvolvido doença Itai-Itai e anomalias renais, incluindo proteinúria e glicosúria.

As vítimas deste envenenamento eram quase exclusivamente mulheres pós-menopausa com baixo teor de ferro e outras lojas de corpo mineral. Similar exposições cádmio população em geral em outras partes do mundo não ter resultado nos mesmos problemas de saúde porque as populações mantido ferro suficiente e outros níveis de minerais. Assim, enquanto o cádmio é um fator importante na doença Itai-Itai no Japão, a maioria dos pesquisadores concluíram que ele foi um dos vários fatores. O cádmio é um dos seis substâncias banidas pela União Europeia de Restrição à directiva Perigosos Substâncias (RoHS), que proíbe determinadas substâncias perigosas em equipamentos eléctricos e electrónicos, mas permite certas isenções e exclusões do âmbito de aplicação da lei.
Apesar de alguns estudos ligaram a exposição ao cádmio com pulmão e câncer de próstata, ainda há uma controvérsia considerável sobre a carcinogenicidade de cádmio. Estudos mais recentes sugerem que o arsénio em vez de cádmio pode levar ao aumento das taxas de mortalidade por câncer de pulmão. Além disso, a maioria dos dados sobre a carcinogenicidade de cádmio confiam nos estudos confundido pela presença de outras substâncias cancerígenas.
O tabagismo é a fonte mais importante de exposição ao cádmio na população em geral. Estimou-se que cerca de 10% do teor de cádmio de um cigarro é inalado através de fumar. A absorção do cádmio dos pulmões é muito mais eficaz do que a partir do intestino, e tanto quanto 50% do cádmio inalado através de fumo do cigarro pode ser absorvida.
Em média, os fumantes têm 4-5 vezes mais elevadas concentrações de cádmio no sangue e 2-3 vezes mais elevados concentrações de cádmio nos rins do que não-fumantes. Apesar do alto teor de cádmio na fumaça do cigarro, parece haver pouca exposição ao cádmio a partir de tabagismo passivo. Nenhum efeito significativo sobre as concentrações de cádmio no sangue foi detectado em crianças expostas à fumaça ambiental do tabaco.
A exposição ao cádmio é um fator de risco associado com a aterosclerose precoce e hipertensão, que tanto pode levar a doenças cardiovasculares.
Regulamentos
Devido aos efeitos adversos sobre o ambiente ea saúde humana, o fornecimento ea utilização de cádmio é restrito na Europa sob o Regulamento REACH.
Recalls de produtos
Em maio de 2006, a venda dos bancos de Arsenal FC antigo estádio 's, Highbury, em Londres, Inglaterra foi cancelada após os assentos foram descobertos para conter pequenas quantidades de cádmio. Relatórios de altos níveis de utilização de cádmio em jóias infantil em 2010 levou a um US Investigação Consumer Product Safety Commission. Os avisos de recall específicas US CPSC emitidos para o teor de cádmio aplicáveis às jóias vendidas por Claire e Lojas Wal-Mart. Em junho de 2010 McDonald voluntariamente recall de mais de 12 milhões promocional "Shrek Forever After 3D" copos colecionáveis devido a preocupações sobre os níveis de cádmio em pigmentos de tintas utilizadas na copos. Os óculos foram fabricados pela Arc International, de Millville, NJ, EUA.

