
Roentgenium
Informações de fundo
Crianças SOS voluntários ajudaram a escolher artigos e fez outro material currículo Patrocinar uma criança para fazer uma diferença real.
| Roentgenium | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
111 Rg | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||||||||||
| prateado (previsto) | |||||||||||||||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | roentgenium, Rg, 111 | ||||||||||||||||||||||||||||||||||||
| Pronúncia | / r ʌ n t ɡ ɛ n Eu ə m / runt- GEN -ee-əm ou / r ɛ n t ɡ ɛ n Eu ə m / rent-GEN -ee-əm | ||||||||||||||||||||||||||||||||||||
| Categoria elemento | desconhecido mas, provavelmente, um metal de transição | ||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | 11, 7, d | ||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | [281] | ||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Rn ] 5f 14 6d 9 7s 2 (Previsto) 2, 8, 18, 32, 32, 17, 2 (Previsto) 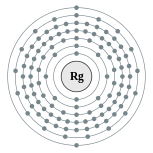 | ||||||||||||||||||||||||||||||||||||
| História | |||||||||||||||||||||||||||||||||||||
| Descoberta | Gesellschaft für Schwerionenforschung (1994) | ||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||
| Fase | sólido (prevista) | ||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 28,7 (prevista) · g cm -3 | ||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 5, 3, 1, -1 (prevista) | ||||||||||||||||||||||||||||||||||||
| Energias de ionização ( Mais) | 1º: 1.022,7 (estimado) kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| Segunda: 2074,4 (avaliado) kJ mol -1 · | |||||||||||||||||||||||||||||||||||||
| 3: 3.077,9 (estimado) kJ · mol -1 | |||||||||||||||||||||||||||||||||||||
| Raio atômico | 114 (prevista) pm | ||||||||||||||||||||||||||||||||||||
| O raio de covalência | 121 (avaliado) pm | ||||||||||||||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 54386-24-2 | ||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de roentgenium | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
Roentgenium é um elemento químico com o símbolo Rg e número atômico 111. É extremamente radioativo elemento sintético (um elemento que pode ser criado num laboratório, mas não se encontra na natureza); o isótopo mais estável conhecida, roentgenium-281, tem uma meia-vida de 26 segundos. Roentgenium foi criado pela primeira vez em 1994 pelo Centro Helmholtz GSI de Heavy Ion Research perto Darmstadt, Alemanha. É nomeado após o físico Wilhelm Röntgen (também escrito Roentgen).
Na tabela periódica , que é um d-bloco elemento transactinide. Ele é um membro da 7a período e é colocado no grupo 11 elementos, embora não há experiências químicas foram realizados para confirmar que ele se comporta como o mais pesado homólogo de ouro no grupo 11. Roentgenium é calculada como tendo propriedades semelhantes ao seu homólogos mais leves, cobre , prata , ouro e, embora possa exibir algumas diferenças em relação a eles.
História

Descoberta oficial
Roentgenium foi sintetizado pela primeira vez por uma equipe internacional liderada por Sigurd Hofmann, da Gesellschaft für Schwerionenforschung (GSI) em Darmstadt, Alemanha , em 8 de dezembro de 1994. A equipe bombardeou um alvo de bismuto-209 com núcleos acelerados de níquel -64 e detectou um único átomo do isótopo roentgenium-272:
Em 2001, o Grupo de Trabalho Conjunto IUPAC / IUPAP (JWP) concluiu que não havia provas suficientes para a descoberta naquele momento. A equipe de GSI repetiu o experimento em 2002 e detectou mais três átomos. Em seu relatório de 2003, a JWP decidiu que a equipe GSI deve ser reconhecido para a descoberta deste elemento.
Nomeando
O nome roentgenium (Rg) foi sugerido pela equipe GSI em homenagem ao físico alemão Wilhelm Conrad Röntgen, o descobridor da Raios-X, em 2004. Este nome foi aceite pelo IUPAC em 01 de novembro de 2004.
Nucleosynthesis
Elementos super-pesados como roentgenium são produzidos bombardeando elementos mais leves em aceleradores de partículas que induzem reações de fusão. Considerando que o isótopo mais leve de roentgenium, roentgenium-272, pode ser sintetizado diretamente Desta forma, todos os isótopos mais pesados Roentgenium só foram observados como produtos de decaimento de elementos com maiores números atómicos .
Consoante as energias envolvidas, as reacções de fusão podem ser classificados como "quente" ou "fria". Em reações de fusão quente, muito leves, projéteis de alta energia são acelerados em direção a metas muito pesados ( actinídeos ), dando origem a núcleos compostos em energia de alta excitação (~ 40-50 MeV) que podem ou fissão ou evaporar várias (3-5) nêutrons. Nas reações de fusão a frio, os núcleos fundidos produzidos têm uma relativamente baixa energia de excitação (~ 10-20 MeV), o que diminui a probabilidade de que estes produtos serão submetidos a reações de fissão. Como os núcleos fundidos arrefecer para a estado fundamental, que necessitam de emissão de apenas um ou dois neutrões, e, assim, permite a geração de mais produtos ricos em neutrões. O último é um conceito distinto do de fusão nuclear, onde reivindicado para ser alcançada em condições de temperatura ambiente (ver a fusão a frio).
A fusão a frio
Antes da primeira síntese bem sucedida de roentgenium em 1994 pela Equipe GSI, uma equipe da Instituto Conjunto de Pesquisa Nuclear em Dubna, Rússia, também tentou sintetizar roentgenium bombardeando bismuto-209 com o níquel-64 em 1986. Não foram identificados roentgenium átomos. Depois de uma atualização de suas instalações, a equipe da GSI detectado com sucesso 3 átomos de 272 Rg em sua experiência de descoberta. A mais três átomos foram sintetizados em 2002. A descoberta de roentgenium foi confirmada em 2003, quando uma equipe da RIKEN mediu os decaimentos de 14 átomos de 272 Rg.
O mesmo isótopo roentgenium também foi observado por uma equipe americana na Lawrence Berkeley National Laboratory (LBNL) a partir da reação:
- 208
82 Pb + 65
29 Cu → 272
111 Rg + n
Esta reacção foi realizada como parte de seu estudo de projéteis com ímpar número atômico em reações de fusão a frio.
Como produto do decaimento
| Resíduo de evaporação | Observado isótopo roentgenium |
|---|---|
| Uus 294, 290 UUP, 286 Uut | 282 Rg |
| Uus 293, 289 UUP, 285 Uut | 281 Rg |
| 288 UUP, 284 Uut | 280 Rg |
| 287 UUP, 283 Uut | 279 Rg |
| 282 Uut | 278 Rg |
| 278 Uut | 274 Rg |
Todos os isótopos de roentgenium excepto roentgenium-272 foram detectados apenas nas cadeias de desintegração de elementos com um maior número atómico , tais como unúntrio . Unúntrio atualmente tem seis isótopos conhecidos; todos eles submetidos a alfa decai para se tornar núcleos Roentgenium, com números de massa entre 274 e 282. núcleos unúntrio Pais podem ser eles mesmos produtos de decaimento de ununpentium ou Ununseptium. Até o momento, não há outros elementos têm sido conhecida a decair para roentgenium. Por exemplo, em janeiro de 2010, a equipe de Dubna ( JINR) identificou roentgenium-281 como um produto final do decaimento de Ununseptium através de uma sequência de decaimento alfa:
- 293
117 Uus → 289
115 + 4 UUP
2 Ele - 289
115 UUP → 285
113 Uut + 4
2 Ele - 285
113 Uut → 281
111 Rg +4
2 Ele
Isótopos
| Isótopo | Meia-vida | Decadência modo | Descoberta ano | Reação |
|---|---|---|---|---|
| 272 Rg | 3,8 ms? | α | 1994 | 209 Bi (64 Ni, n) |
| 273 Rg | 5? Senhora | α? | desconhecido | - |
| 274 Rg | 6,4 ms | α | 2004 | 278 Uut (-, α) |
| 275 Rg | 10? Senhora | α? | desconhecido | - |
| 276 Rg | 100? Senhora | α, SF? | desconhecido | - |
| 277 Rg | 1? s | α, SF? | desconhecido | - |
| 278 Rg | 4.2 ms | α | 2006 | 282 Uut (-, α) |
| 279 Rg | 0,17 | α | 2003 | 287 UUP (-, 2α) |
| 280 Rg | 3,6 s | α | 2003 | 288 UUP (-, 2α) |
| 281 Rg | 26 | SF | 2009 | Uus 293 (-, 3α) |
| 282 Rg | 0,5 s | α | 2009 | Uus 294 (-, 3α) |
| 283 Rg | 10? min | α, SF? | desconhecido | - |
Roentgenium não tem isótopos estáveis ou que ocorrem naturalmente. Vários isótopos radioactivos foram sintetizados no laboratório, quer por fusão dos núcleos de elementos mais leves ou como produtos de decomposição intermédios de elementos mais pesados. Sete isótopos diferentes de roentgenium foram relatados com massas atômicas 272, 274 e 278-282, dois dos quais, roentgenium-272 e roentgenium-274, já conhecida, mas não confirmado estados metaestáveis. Todos estes decadência através de decaimento alfa exceto roentgenium-281, que sofre fissão espontânea.
Estabilidade e meias-vidas
Todos os isótopos Roentgenium são extremamente instável e radioativo; em geral, os isótopos mais pesados são mais estáveis do que o isqueiro. O isótopo roentgenium conhecido mais estável, 281 Rg, é também o segundo mais pesado roentgenium conhecido isótopo; que tem uma meia-vida de 26 segundos. O isótopo 280 Rg tem sido relatada como também têm uma semi-vida de mais de um segundo. O isótopos 282 e 279 Rg Rg têm meia-vida de 0,5 e 0,17 segundos, respectivamente. Os restantes quatro isótopos tem uma meia-vida entre 1 e 10 milissegundos. O isótopo não descoberto 287 Rg foi previsto para ser o mais estável no sentido decaimento beta; no entanto, nenhum isótopo roentgenium conhecido tem sido observada a sofrer decaimento beta. Os isótopos desconhecidos 277 Rg e Rg 283 também se espera que tenham meias-vidas longas de 1 segundo e 10 minutos, respectivamente. Antes da sua descoberta, o isótopos 278 Rg, Rg 281, e 282 foram previstos para Rg têm meias-vidas longas de 1 segundo, 1 minuto, e 4 minutos respectivamente; no entanto, eles foram descobertos ter mais curtas semi-vidas de 4,2 milissegundos, 26 segundos, e 0,5 segundos respectivamente.
Isomeria nuclear
- 274 Rg
Dois átomos de 274 Rg têm sido observados no cadeia de decaimento de 278 Uut. A Eles decair por emissão alfa, que emite partículas alfa com energias diferentes, e têm diferentes tempos de vida. Além disso, as duas cadeias de desintegração inteiras parecem ser diferentes. Isto sugere a presença de dois isômeros nucleares, mas mais pesquisas são necessárias.
- 272 Rg
Quatro partículas alfa emitidas a partir de 272 Rg com energias de 11,37, 11,03, 10,82 e 10,40 MeV foram detectados. O GSI medido 272 Rg ter uma meia-vida de 1,6 ms enquanto que dados recentes de RIKEN atribuiram uma meia-vida de 3,8 ms. Os dados em conflito pode ser devido a isómeros nucleares, mas os dados correntes são insuficientes para chegar a todas as atribuições firmes.
Propriedades previstas
Químico
Roentgenium é o nono membro da série 6d de metais de transição . Desde copernicium (elemento 112) tem mostrado ser um metal de transição, é esperado que todos os elementos de 104 a 112 iria formar uma quarta séries de metal de transição. Os cálculos relativos a sua e potenciais de ionização atômica e raios iónicos são semelhantes ao do seu homólogo de isqueiro de ouro , o que implica, portanto, que as propriedades básicas do Roentgenium será semelhante aos da outra grupo 11 elementos, cobre , prata , e de ouro; No entanto, também se prevê que mostram várias diferenças de seus homólogos mais leves.
Roentgenium está previsto para ser um metal nobre. Com base nos estados de oxidação mais estável do grupo isqueiro 11 elementos, roentgenium está previsto para mostrar estáveis 5, 3 estados, e -1 de oxidação, com um menos um estado estável. O estado 3 está previsto para ser o mais estável. Roentgenium (III) deverá ser de reactividade comparável ao ouro (III), mas deve ser mais estável e formam uma grande variedade de compostos. Ouro também forma um estado -1 ou menos estável devido aos efeitos relativísticos, e roentgenium pode fazê-lo também. Os orbitais 6d são desestabilizadas por e os efeitos relativísticos interacções spin-órbita perto do fim da quarta séries de metal de transição, tornando assim os estados de oxidação mais elevados como roentgenium (V) e copernicium (IV) mais estável do que os seus homólogos mais leves ouro (V) e mercúrio (IV) (cada um dos quais são conhecidos apenas em um composto) como os electrões 6d participar na ligação a uma maior extensão. As interações spin-órbita estabilizar compostos Roentgenium moleculares com elétrons 6d mais de colagem; por exemplo, Rgf -
6 está prevista para ser mais estável do que o RGF -
4, que se espera que seja mais estável do que o RGF -
2. Roentgenium (I) está prevista para ser difícil de obter.
A química provável de roentgenium recebeu mais interesse do que a dos dois elementos anteriores, meitnério e Darmstadti , como a valência s- subshells do grupo de 11 elementos deverão ser contratados relativisticamente mais fortemente em roentgenium. Os cálculos sobre o composto molecular Rg H mostram que os efeitos relativísticos dobrar a força da ligação roentgenium-hidrogênio, embora interações spin-órbita também enfraquecê-lo por 0,7 eV. Os compostos de Au e RGX X, em que X = F , Cl , Br , S , Au, ou Rg, foram também estudados.
Física e atômica
Roentgenium se espera que seja um sólido em condições normais. Deve ser um metal muito pesado com uma densidade de cerca de 28,7 g / cm 3; Em comparação, o elemento mais denso conhecido que teve a sua densidade medida, ósmio , tem uma densidade de apenas 22,61 g / cm 3. Isto resulta do elevado peso atômico do roentgenium, o lantanídeos e actinídeos contrações, e os efeitos relativísticos, embora a produção de roentgenium suficiente para medir essa quantidade seria impraticável, ea amostra seria rapidamente decair.
O grupo estável 11 elementos, cobre, prata e ouro, todos têm uma configuração eletrônica externa nd 10 (n + 1) s 1. Para cada um destes elementos, o primeiro estado dos seus átomos animado tem uma configuração ND 9 (n + 1) s 2. Devido a acoplamento spin-órbita entre as d elétrons, este estado é dividido em um par de níveis de energia. Para o cobre, a diferença de energia entre o estado fundamental e menor estado animado faz com que o metal a aparecer avermelhada. Para a prata, o gap de energia aumenta e torna-se prateado. No entanto, como o número atómico aumenta, os níveis excitados são estabilizadas por efeitos relativistas e em ouro a abertura de energia diminui novamente e parece ouro. Para roentgenium, cálculos indicam que o nível 6d 9 7s 2 é estabilizada de tal modo que se torna o estado fundamental e o 6d 10 7s um nível torna-se o primeiro estado animado. A diferença entre a energia resultante do novo estado fundamental e o primeiro estado animado é semelhante ao de prata e roentgenium deverá ser prateado na aparência. O raio atômico de roentgenium é esperado para ser em torno de 114 pm.
Química experimental
Determinação inequívoca de as características químicas das roentgenium ainda tem de ter sido estabelecida, devido aos baixos rendimentos de reacções que produzem isótopos Roentgenium. Para estudos químicos para ser levada a cabo numa transactinide, pelo menos quatro átomos deve ser produzido, a semi-vida do isótopo utilizado deve ser, pelo menos, 1 segundo e a taxa de produção deve ser, pelo menos, um átomo de por semana. Embora a semi-vida de 281 Rg, o mais estável isótopo roentgenium conhecida, é de 26 segundos, tempo suficiente para realizar estudos químicos, outro obstáculo é a necessidade de aumentar a taxa de produção de isótopos Roentgenium e permitir experiências para continuar por semana ou meses para que os resultados estatisticamente significativos podem ser obtidos. A separação e detecção deve ser realizada de forma contínua para separar os isótopos Roentgenium e sistemas automáticos, então pode experimentar na fase gasosa e em solução química de roentgenium como os rendimentos para os elementos mais pesados, é previsível que sejam menores do que aqueles para os elementos mais leves. No entanto, a química experimental de roentgenium não recebeu tanta atenção quanto a do mais pesado elementos copernicium e fleróvio .
