
Vanádio
Fundo para as escolas Wikipédia
Arranjar uma seleção Wikipedia para as escolas no mundo em desenvolvimento sem internet foi uma iniciativa da SOS Children. Patrocinar uma criança para fazer uma diferença real.
| Vanádio | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
23 V | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Aparência | ||||||||||||||||||||||||||||||||||
-azul-cinza prata metálica  | ||||||||||||||||||||||||||||||||||
| Propriedades gerais | ||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | vanádio, V, 23 | |||||||||||||||||||||||||||||||||
| Pronúncia | / v ə n eɪ d Eu ə m / və- NAY -dee-əm | |||||||||||||||||||||||||||||||||
| Categoria Metallic | de metal de transição | |||||||||||||||||||||||||||||||||
| Grupo, período, bloco | 5, 4, d | |||||||||||||||||||||||||||||||||
| Peso atômico padrão | 50,9415 (1) | |||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Ar ] 3d 3 4s 2 2, 8, 11, 2 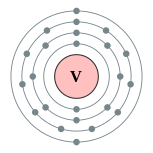 | |||||||||||||||||||||||||||||||||
| História | ||||||||||||||||||||||||||||||||||
| Descoberta | Andrés Manuel del Río (1801) | |||||||||||||||||||||||||||||||||
| Primeiro isolamento | Nils Gabriel Sefström (1830) | |||||||||||||||||||||||||||||||||
| Nomeado por | Nils Gabriel Sefström (1830) | |||||||||||||||||||||||||||||||||
| Propriedades físicas | ||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 6,0 g · cm -3 | |||||||||||||||||||||||||||||||||
| Líquido densidade no pf | 5,5 g · cm -3 | |||||||||||||||||||||||||||||||||
| Ponto de fusão | 2183 K , 1910 ° C, 3470 ° F | |||||||||||||||||||||||||||||||||
| Ponto de ebulição | 3680 K, 3407 ° C, 6165 ° F | |||||||||||||||||||||||||||||||||
| Calor de fusão | 21,5 kJ mol -1 · | |||||||||||||||||||||||||||||||||
| Calor de vaporização | 459 kJ mol -1 · | |||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 24.89 J · · mol -1 K -1 | |||||||||||||||||||||||||||||||||
| Pressão de vapor | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Propriedades atômicas | ||||||||||||||||||||||||||||||||||
| Estados de oxidação | 5, 4, 3, 2, 1, -1 ( óxido anfotérico) | |||||||||||||||||||||||||||||||||
| Eletronegatividade | 1,63 (escala de Pauling) | |||||||||||||||||||||||||||||||||
| Energias de ionização ( Mais) | 1º: 650,9 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| Segunda: 1414 kJ mol -1 · | ||||||||||||||||||||||||||||||||||
| 3: 2830 kJ · mol -1 | ||||||||||||||||||||||||||||||||||
| Raio atômico | 134 pm | |||||||||||||||||||||||||||||||||
| O raio de covalência | 153 ± 20:00 | |||||||||||||||||||||||||||||||||
| Miscelânea | ||||||||||||||||||||||||||||||||||
| A estrutura de cristal | cúbica de corpo centrado  | |||||||||||||||||||||||||||||||||
| Ordenamento magnético | paramagnético | |||||||||||||||||||||||||||||||||
| Resistividade elétrica | (20 ° C) 197 Nco · m | |||||||||||||||||||||||||||||||||
| Condutividade térmica | 30,7 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||
| Expansão térmica | (25 ° C) de 8,4 uM · · K -1 m -1 | |||||||||||||||||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C) 4560 m · s -1 | |||||||||||||||||||||||||||||||||
| O módulo de Young | 128 GPa | |||||||||||||||||||||||||||||||||
| Módulo de cisalhamento | 47 GPa | |||||||||||||||||||||||||||||||||
| Massa de módulo | 160 GPa | |||||||||||||||||||||||||||||||||
| Rácio de Poisson | 0.37 | |||||||||||||||||||||||||||||||||
| Dureza de Mohs | 6,7 | |||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-62-2 | |||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | ||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de vanádio | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
O vanádio é um elemento químico com o símbolo V e número atômico 23. É um duro, cinza prateado, dúctil e maleável metal de transição . O elemento é encontrado apenas em forma quimicamente combinada na natureza, mas uma vez isolado artificialmente, a formação de uma camada de óxido de estabiliza o metal livre um pouco contra a oxidação adicional. Andrés Manuel del Río descoberto compostos de vanádio, em 1801, através da análise de um novo mineral de chumbo tendo-ele chamou de "lead marrom", e presume suas qualidades foram devido à presença de um novo elemento, que ele chamou de erythronium (grego para "vermelho") uma vez que, após aquecimento, a maior parte dos seus sais girado da sua cor inicial para vermelho. Quatro anos mais tarde, porém, ele foi convencido por outros cientistas que erythronium era idêntico ao crómio. Cloretos de vanádio foram gerados em 1830 por Nils Gabriel Sefström que, assim, provado que um novo elemento estava envolvido, que ele chamou de "vanádio", após a Deusa germânica da beleza e da fertilidade, VANADIS ( Freyja). Ambos os nomes foram atribuídos à grande variedade de cores encontradas em compostos de vanádio. Mineral a vantagem da Del Rio foi rebatizado mais tarde vanadinite por seu conteúdo de vanádio. Embora Berzelius alegou ter isolado pela primeira vez de vanádio na década de 1830, em 1867 Henry Enfield Roscoe mostrou que ele só tinha obtido o óxido e, finalmente, em 1869 Roscoe demonstrou um método para obter o elemento puro.
O vanádio ocorre naturalmente em cerca de 65 diferentes minerais e em combustíveis fósseis depósitos. Ele é produzido na China e na Rússia a partir de fundição de aço escória; outros países produzi-lo a partir da escória de aciaria de óleo pesado, ou como um subproduto da mineração de urânio. É usada principalmente para a produção de aços especiais Ligas tais como o aços ferramenta de alta velocidade. O composto de vanádio industrial mais importante, pentóxido de vanádio, é usada como um catalisador para a produção de ácido sulfúrico .
Grandes quantidades de iões de vanádio são encontrados em poucos organismos, possivelmente como uma toxina. O óxido e alguns outros sais de vanádio têm toxicidade moderada. Particularmente no oceano, o vanádio é usado por algumas formas de vida como um centro activo das enzimas, tais como a vanádio Bromoperoxidase de algumas algas oceano. O vanádio é provavelmente um micronutrientes em mamíferos, incluindo os seres humanos, mas o seu papel preciso a este respeito é desconhecido.
História
Vanádio era originalmente descoberto por Andrés Manuel del Río, um mineralogista espanhol mexicano-nascido, em 1801. Del Río extraiu o elemento de uma amostra de minério mexicano "lead brown", mais tarde nomeado vanadinite. Ele descobriu que os seus sais exibem uma grande variedade de cores, e como resultado, ele nomeou o panchromium elemento (em grego: παγχρώμιο "todas as cores"). Mais tarde, Del Río rebatizado de erythronium elemento (em grego: ερυθρός "vermelho") como a maioria de seus sais ficou vermelho após aquecimento. Em 1805, o químico francês Hippolyte Victor Collet-Descotils, apoiado pelo amigo de Baron del Río Alexander von Humboldt, incorretamente declarou que novo elemento del Río foi apenas uma amostra impura de cromo . Del Río aceito declaração Collet-Descotils 'e retirou sua reivindicação.
Em 1831, o químico sueco Nils Gabriel Sefström redescobriu o elemento em um novo óxido ele encontrou ao trabalhar com minérios de ferro. Mais tarde, naquele mesmo ano, Friedrich Wöhler confirmou trabalho anterior del Río. Sefström escolheu um nome que começa com V, o que não tinha sido atribuído a qualquer elemento ainda. Ele chamou o vanádio elemento após Old Norse VANADIS (outro nome para a Norse Vanr deusa Freyja, cujas facetas incluem conexões com beleza e fertilidade), por causa dos muitos belamente coloridas compostos químicos que produz. Em 1831, o geólogo George William Featherstonhaugh sugeriu que vanádio devem ser renomeada como "rionium" após del Río, mas esta sugestão não foi seguida.

O isolamento de vanádio de metal revelou-se difícil. Em 1831, Berzelius relatou a produção do metal, mas Henry Enfield Roscoe mostrou que Berzelius teve, de facto, o nitreto produzida, nitreto de vanádio (VN). Roscoe acabou por produzir o metal em 1867 por redução de vanádio (II), cloreto de VCl 2, com hidrogénio . Em 1927, vanádio puro foi produzido através da redução pentóxido de vanádio com cálcio . A primeira utilização industrial em larga escala de vanádio no aço foi localizado no chassis do Ford Modelo T, inspirado por carros de corrida franceses. Vanádio aço permitido para redução de peso, aumentando simultaneamente resistência à tracção.
Características

O vanádio é um duro, dúctil, metal cinza-prateado. Algumas fontes descrevem vanádio como "soft", talvez porque ele é dúctil, maleável e não frágil. O vanádio é mais difícil do que a maioria dos metais e aços (veja Durezas dos elementos (página de dados) e ferro ). Possui uma boa resistência à corrosão e que é estável contra álcalis, sulfúrico e clorídrico ácidos. É oxidado em ar a cerca de 933 K (660 ° C, 1220 ° F), embora tenha formado uma camada de óxido, mesmo à temperatura ambiente.
Isótopos
De ocorrência natural de vanádio é composto de uma estável isótopo 51 V e um isótopo radioactivo 50 V. O último tem uma meia-vida de 1,5 x 10 17 anos e uma abundância natural 0,25%. 51 V tem um spin nuclear de 7/2, que é útil para a espectroscopia de RMN . 24 artificial radioisótopos têm sido caracterizados, variando em número de massa de 40 a 65. A medida mais estável destes isótopos são 49 V, com uma semi-vida de 330 dias e de 48 V com uma semi-vida de 16,0 dias. Todos os restantes isótopos radioativos têm meia-vida mais curta do que uma hora, a maioria dos quais estão abaixo de 10 segundos. Pelo menos quatro isótopos têm estados excitados metaestáveis. Captura de elétrons é o principal modo de decaimento de isótopos mais leves do que os 51 V. Para os mais pesados, o modo mais comum é decaimento beta. As reacções de captura de electrões levar à formação do elemento 22 ( titânio ) isótopos, enquanto que para o decaimento beta, que conduz a elemento (24 crómio ) isótopos.
Química e compostos

A química de vanádio é notável para a acessibilidade dos quatro adjacentes estados de oxidação 2-5. Em solução aquosa as cores são lilás V 2+ (aq), V verde 3+ (aq), azul VO 2+ (aq) e, a pH elevado, amarelo VO 4 2-. O vanádio (ii) os compostos são agentes redutores, e vanádio (V) os compostos são agentes oxidantes. O vanádio (IV) existem como compostos frequentemente derivados de vanadilo que contêm o centro VO 2+.
Vanadato de amónio (V) (NH 4 VO 3) pode ser reduzido sucessivamente com elementar de zinco para obter as diferentes cores de vanádio nos estados de oxidação estes quatro. Estados de oxidação mais baixos ocorrem em compostos, tais como V (CO) 6, [V (CO) 6] - e os seus derivados substituídos.
O bateria redox de vanádio utiliza todos os quatro estados de oxidação; um eletrodo utiliza a + 5 / + 4 casal eo outro usa o + 3 / + 2 casal. Conversão destes estados de oxidação é ilustrada pela redução de uma solução fortemente acídica de um composto de vanádio (V) com pó de zinco ou amálgama. A característica cor amarela inicial do ião pervanadyl [VO 2 (H2O) 4] + é substituída pela cor azul de [VO (H2O) 5] 2+, seguido pela cor verde de [V (H 2 O) 6] 3+ e, em seguida, a cor violeta devido a [V (H2O) 6] 2+.
O composto mais importante é comercialmente pentóxido de vanádio, o qual é utilizado como um catalisador para a produção de ácido sulfúrico. Este composto oxida dióxido de enxofre (SO2) à trióxido (SO 3). Neste reacção redox, o enxofre é oxidado 4-6, e vanádio é reduzida 5-3:
- V 2 O 5 + 2 SO2 → V 2 O 3 + 2 SO 3
O catalisador é regenerado por oxidação com ar:
- V 2 O 3 + O 2 → V 2 O 5
Oxi-ânions e cátions

A química oxiani�o de vanádio (V) é complexo: a diagrama predominância para vanadatos em solução aquosa mostra, pelo menos, 11 espécies de ser predominante sob condições específicas de pH e concentração. O íon vanadate tetrahedral, VO 3-
4, é as principais espécies presentes a pH 12-14. Por acidificação, o monómero [HVO 4] 2- e dímero [V 2 O 7] - são formadas, com o monómero predominante na concentração de vanádio de menos do que cerca de 10 -2 M (PV> 2; PV é igual a menos do logaritmo da concentração total de vanádio / M). A formação do ião divanadate é análoga à formação do ion dicromato. À medida que o pH é reduzido, mais protonação e a polimerização polyvanadates ocorrer: a pH 4-6 [H 2 VO 4] - é predominante no PV superior a ca. 4, enquanto que em elevadas concentrações de trímeros e tetrâmeros são formados. Entre pH 2-4 decavanadates predominam. Em decavanadates há um octaedro distorcido de átomos de oxigênio em torno de cada átomo de vanádio. Ácido vanádico, H 3 VO 4 tem uma concentração muito baixa por causa protonação das espécies tetraédricas [H 2 VO 4] - resulta na formação preferencial do octaédrico [VO 2 (H2O) 4] + espécies. Em soluções fortemente ácidas, pH <2. [VO 2 (H2O) 4] + é a espécie predominante, enquanto que o óxido de V 2 O 5, precipita a partir da solução em concentrações elevadas. O óxido é formalmente o anidrido de ácido inorgânico vanadic. As estruturas de muitos destes e de outros iões vanadato foram determinadas por cristalografia de raios-X de compostos cristalinos.
As constantes de dissociação de ácido para a série de vanádio e fósforo são notavelmente semelhantes. Correntes, anéis e clusters que envolvem vanádio tetrahedral, análogo ao polifosfatos, são conhecidos. A correspondência entre o vanadato e química de fosfato pode ser atribuído à semelhança em tamanho e carga de fósforo (V) e vanádio (V). Ortovanadato V O 3-
4 é utilizado em cristalografia de proteínas para o estudo da bioquímica de fosfato.
O Pourbaix diagrama de vanádio em água, que mostra o potenciais redox entre várias espécies de vanádio em diferentes estados de oxidação também é complexa.
Vanádio (V) também faz várias peroxo-complexos. A espécie VO (O) 2 (H2O) 4 + está presente em soluções ácidas. Em espécies soluções alcalinas com 2, 3 e 4 grupos de peróxido estão presentes; as últimas formas de cristais violeta M 3 V (O 2) 4 nH2O (M = Li, Na, K, NH4 +), na qual o vanádio tem uma 8 estrutura coordenada dodecaédrico.
Compostos calcogeneto e iodetos
Vanádio forma uma muito grande variedade de compostos binários com enxofre, selénio e telúrio, muitas vezes com estruturas complicadas. A tetraédrico sulfa-anião [VS 4] 3-, análogo ao ião ortovanadato, é bem conhecido, mas não há tio-análogos dos polímeros oxo-vanadatos.
Todos os quatro halogenetos são conhecidos por estados de oxidação 2 e 3, mas o iodeto não é conhecida para V (IV) e 5 VF é a única conhecida halogeneto para o estado de oxidação 5. VCl 4 pode ser usada como um catalisador para a polimerização de dienos.
Exemplos de oxihaletos incluir.
- vanádio (V): VOF 3, VOX 3 e VO 2 X (X = F, Cl)
- vanádio (IV): VOX 2 (X = F, Cl, Br)
- vanádio (III): VOX, (X = Cl, Br)
Compostos de coordenação
Posição inicial de vanádio no metal de transição série levam a três características bastante incomuns da química de coordenação de vanádio. Em primeiro lugar, vanádio metálico tem a configuração eletrônica [Ar] 3d 3 4s 2, portanto, compostos de vanádio são relativamente poucos elétrons. Por conseguinte, a maioria dos compostos são binários Ácidos Lewis (par de elétrons aceitantes); exemplos são todos os que formam adutos halogenetos octaédricos com a fórmula VX n n G 6- (X = halogeneto; G = outro ligando). Em segundo lugar, o ião de vanádio é relativamente grande e pode atingir números de coordenação superiores a 6, como é o caso em [V (CN) 7] 4-. Em terceiro lugar, o ion de vanádio, VO 2+, é destaque em muitos complexos de vanádio (IV), como acetilacetonato de vanadilo (V (= O) 5 (C 5 H 7) 2). Nesse complexo, o vanádio é o 5-coordenadas, piramidal quadrada, o que significa que um sexto do ligando, tal como a piridina, podem ser ligados, embora a constante de associação do presente processo é pequena. Muitas 5-coordenam complexos de vanadilo tem uma geometria bypyramidal trigonal, tais como VOCL 2 (NMe 3) 2.
Os compostos organometálicos
Química organometálica de vanádio é bem desenvolvido, mas os compostos organometálicos são de menor importância comercial. Vanadocene dicloreto é um reagente de partida versátil e mesmo menores encontra aplicações em química orgânica. Vanadium carbonilo, V (CO) 6, é um raro exemplo de um carbonilo de metal contendo um elétron não emparelhado, mas que existe sem dimerização. A adição de um rendimento de electrões V (CO) -
6 ( isoeletrônica com Cr (CO) 6), o qual pode ser ainda mais reduzida com sódio em amoníaco líquido, para se obter V (CO) 3-
6 (isoeletrônica com Fe (CO) 5).
Ocorrência
Vanádio metálico não é encontrado na natureza, mas é conhecida por existir em cerca de 65 diferentes minerais . Exemplos economicamente importantes incluem patronite (VS 4), vanadinite (Pb 5 (VO 4) 3 Cl), e carnotite (K 2 (UO2) 2 (VO 4) 2 · 3H 2 O). Grande parte da produção de vanádio do mundo é proveniente de vanádio-bearing magnetite encontrados em ultramafic corpos gabro. Vanádio é extraído principalmente na África do Sul , noroeste da China , e no leste da Rússia . Em 2010, estes três países extraído mais de 98% do 56.000 toneladas de vanádio produzidos.
O vanádio está presente também em bauxita e em combustíveis fósseis , tais como depósitos de petróleo bruto , carvão , xisto betuminoso e areias betuminosas. Em petróleo bruto, foram notificadas concentrações até 1200 ppm. Quando tais produtos derivados de petróleo são queimados, os vestígios de vanádio pode dar início a corrosão em motores e caldeiras. Estima-se que 110 mil toneladas de vanádio por ano são liberados na atmosfera pela queima de combustíveis fósseis. Vanádio também foi detectado por espectroscopia na luz do Sol e algumas outras estrelas .
Produção
Mais de vanádio é usado como uma liga chamada ferrovanádio como um aditivo para melhorar aços . Ferrovanádio é produzido directamente por redução de uma mistura de óxido de vanádio, óxido de ferro e de ferro num forno eléctrico. Vanádio-rolamento minério de ferro magnetita é a principal fonte para a produção de vanádio. O vanádio acaba em ferro-gusa produzido a partir de magnetita rolamento vanádio. Durante A produção de aço, o oxigénio é soprado para dentro do ferro gusa, a oxidação do carbono e a maior parte das outras impurezas, formando escória. Dependendo do minério usado, a escória pode conter até 25% de vanádio.
Vanádio metal é obtido através de um processo de passos múltiplos que começa com a torrefacção de minério triturado com NaCl ou Na 2 CO 3 a cerca de 850 ° C para dar metavanadato de sódio (Navo 3). Um extracto aquoso deste sólido é acidificada para dar "bolo vermelho", um sal polyvanadate, que é reduzido com cálcio metálico. Como uma alternativa para a produção em pequena escala, é o pentóxido de vanádio reduzido com hidrogénio ou de magnésio . Muitos outros métodos também estão em uso, em todos os quais vanádio é produzido como um subproduto de outros processos. Purificação de vanádio é possível pela processo bar cristal desenvolvido pela Anton Eduard van Arkel e Jan Hendrik de Boer em 1925. Ela envolve a formação do iodeto de metal, neste exemplo iodeto de vanádio (III), e a subsequente decomposição para produzir metal puro.
- 2 V + 3 I 2
 2 VI 3
2 VI 3
Aplicações
Alloys
Aproximadamente 85% de vanádio é utilizado como produzido ferrovanádio ou como um aço aditivo. O aumento considerável de força de aço contendo pequenas quantidades de vanádio foi descoberto no início do século 20. Vanádio forma nitretos e carbonetos estáveis, resultando num aumento significativo na resistência do aço. A partir desse momento vanádio aço foi usada para aplicações em quadros eixos, bicicleta, virabrequins, engrenagens e outros componentes críticos. Existem dois grupos de vanádio que contêm grupos de ligas de aço. Vanádio ligas de aço de alto carbono contêm de 0,15% a 0,25% de vanádio e aços ferramenta de alta velocidade (HSS) tem um teor de vanádio de 1% a 5%. Para aços ferramenta de alta velocidade, uma dureza acima BQ 60 pode ser conseguida. HSS aço é utilizado em instrumentos cirúrgicos e ferramentas.
Vanádio estabiliza a forma beta de titânio e aumenta a resistência e estabilidade temperatura de titânio. Misturado com alumínio em titânio ligas é utilizado em motores a jacto , células de alta velocidade e implantes dentários. Uma das ligas é comuns Titânio 6Al-4V, uma liga de titânio com 6% de alumínio e 4% de vanádio.
Outros usos
O vanádio é compatível com ferro e titânio, vanádio, por conseguinte, a folha é usada em revestimento de titânio de aço. O moderado secção transversal de captura de neutrões térmicos e a curta semi-vida dos isótopos produzidos por captura de neutrões de vanádio torna um material adequado para a estrutura interna de um reator de fusão. Várias ligas de vanádio mostram comportamento supercondutor. O primeiro A15 fase supercondutor foi um composto de vanádio, V 3Si, que foi descoberto em 1952. Fita Vanadium-gálio é usado em supercondutores ímãs (17,5 teslas ou 175.000 gauss). A estrutura do supercondutor A15 fase de V 3 Ga é semelhante ao dos mais comuns Nb 3 Sn e Nb Ti 3.
O óxido de vanádio mais comum, pentóxido de vanádio de V 2 O 5, é utilizado como um catalisador na produção de ácido sulfúrico pela processo de contato e como oxidante em produção de anidrido maleico. O pentóxido de vanádio, também é usado em fazer cerâmica. Outro óxido de vanádio, dióxido de vanádio VO 2, é utilizado na produção de revestimentos de vidro, que bloqueia radiação infravermelha (e luz não visível), a uma temperatura específica. Óxido de vanádio podem ser utilizados para induzir centros de cor em corindo para criar simulado jóias alexandrita, embora alexandrite na natureza é uma chrysoberyl. A possibilidade de utilizar pares redox de vanádio em ambas as meias células, eliminando assim o problema da contaminação cruzada pela difusão de iões através da membrana é a vantagem de redox de vanádio baterias recarregáveis. Vanadate pode ser usado para proteger o aço contra a ferrugem e corrosão por revestimento de conversão electroquímica. Óxido de vanádio lítio tem sido proposto para ser utilizado como um ânodo de alta densidade de energia de baterias de iões de lítio, a 745 Wh / l, quando emparelhado com um catodo de óxido de lítio-cobalto. Foi proposto por alguns investigadores que uma pequena quantidade, 40-270 ppm, de vanádio em Wootz aço e aço Damasco , melhora significativamente a resistência do material, embora seja claro que foi a fonte do vanádio.
Papel biológico
Vanadium desempenha um papel muito limitado na biologia , e é mais importante em ambientes de oceano do que em terra.
Bromoperoxidases em algas
Organobromadas compostos em uma série de espécies de organismos marinhos algas são geradas pela acção de um vanádio dependente Bromoperoxidase. Isto é um haloperoxidase em algas que requer brometo e é uma enzima absolutamente vanádio-dependente. A maioria dos compostos organobromadas no mar, em última análise surgem através da acção da presente vanádio Bromoperoxidase.
Acumulação de vanádio em tunicados e ascídias
Químico alemão Martin Henze descoberto vanádio no células do sangue (ou células celômicos) de Ascidiacea (ascídias) em 1911. É essencial ascídias e tunicados, onde é armazenada no altamente acidificado vacúolos de determinados tipos de células sanguíneas, vanadocytes designados. Vanabins (proteínas de ligação de vanádio) foram identificados no citoplasma destas células. A concentração de vanádio no sangue é de até 10 milhões de vezes mais elevada do que a concentração de vanádio na água do mar em torno deles. A função deste sistema de concentração de vanádio, e estas proteínas contendo vanádio, ainda é desconhecido.
Fixação de nitrogênio
A vanádio nitrogenase é usado por alguns fixadoras de nitrogênio microrganismos, tais como Azotobacter. Neste papel vanádio substitui mais comum molibdênio ou ferro , e dá a nitrogenase propriedades ligeiramente diferentes.
Fungos
Várias espécies de macrofungos, nomeadamente Amanita muscaria e espécies afins, acumular vanádio (até 500 mg / kg de peso seco). O vanádio está presente no complexo de coordenação, amavadin, em sumos de frutas-organismos fúngicos. No entanto, a importância biológica do processo de acumulação é desconhecido. Funções de toxinas ou funções enzimáticas da peroxidase foram sugeridas.
Mamíferos e aves
Os ratos e galinhas são também conhecidos para exigir vanádio em quantidades muito pequenas e resultar em deficiências de crescimento reduzida e diminuída reprodução. Vanádio é relativamente controversa suplemento alimentar, principalmente para o aumento de insulina e sensibilidade body-building. Se ele funciona para este último propósito não foi comprovada, e há algumas evidências de que os atletas que tomam são meramente experimentando um efeito placebo. Sulfato de Vanádio pode melhorar o controle de glicose em pessoas com diabetes tipo 2. Além disso, decavanadate oxovanadates e são espécies que potencialmente têm muitas actividades biológicas e que têm sido utilizados com sucesso como ferramentas na compreensão de vários processos bioquímicos.
Segurança
Todos os compostos de vanádio deverá ser considerado tóxico. Tetravalente VOSO4 tem sido relatada como sendo mais de 5 vezes mais tóxico do que trivalente V 2 O 3. O Occupational Safety and Health Administration (OSHA) estabeleceu um limite de exposição de 0,05 mg / m 3 para o pó de pentóxido de vanádio e de 0,1 mg / m3 para fumos de pentóxido de vanádio no ar no local de trabalho para uma jornada de 8 horas, 40 horas de trabalho semanais. O Instituto Nacional de Segurança e Saúde Ocupacional (NIOSH) recomendou que 35 mg / m 3 de vanádio ser considerado imediatamente perigosas à vida e à saúde. Este é o nível de exposição de um produto químico que é susceptível de causar problemas de saúde permanentes ou morte.
Os compostos de vanádio são mal absorvidos através do sistema gastrointestinal. Exposições de inalação de vanádio e compostos de vanádio resultam principalmente em efeitos adversos no sistema respiratório. Os dados quantitativos são, porém, insuficientes para obter uma dose de referência inalação subcrónica ou crónica. Outros efeitos secundários foram reportados após exposições orais ou inalatórios sobre parâmetros sanguíneos, no fígado, no desenvolvimento neurológico em ratos, e outros órgãos.
Há poucas evidências de que compostos de vanádio ou de vanádio são toxinas reprodutivas ou teratogens. O pentóxido de vanádio foi relatado para ser cancerígenos em ratos machos e ratos machos e fêmeas por inalação em um estudo NTP, embora a interpretação dos resultados foi recentemente contestada. Vanadium não foi classificado como carcinogênico pela United States Environmental Protection Agency.
Vanadium traça em combustíveis diesel apresentam um risco de corrosão; é o principal componente do combustível influenciam corrosão a alta temperatura. Durante a combustão, oxida-se e reage com o sódio e o enxofre, obtendo-se vanadato compostos com pontos de fusão abaixo de 530 ° C, que atacam o camada de passivação em aço, tornando-a suscetível à corrosão. Os compostos de vanádio sólidos também causar abrasão de componentes de motores.











