
Rubídio
Fundo para as escolas Wikipédia
Crianças SOS voluntários ajudaram a escolher artigos e fez outro material currículo patrocínio SOS Criança é legal!
| Rubídio | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
37 Rb | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | ||||||||||||||||||||||||||||||||||||||||||||||||||||
branco cinzento  | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | rubídio, Rb, 37 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / r ʉ b ɪ d Eu ə m / BID roo- -ee-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria elemento | metal alcalino | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | (1) metais alcalinos , 5, s | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | 85,4678 (3) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Cr ] 5s 1 2, 8, 18, 8, 1 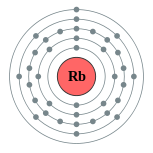 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| História | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descoberta | Robert Bunsen e Gustav Kirchhoff (1861) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Primeiro isolamento | George de Hevesy | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 1.532 g cm -3 · | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidade no pf | 1,46 g cm -3 · | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 312,46 K , 39.31 ° C, 102,76 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 961 K, 688 ° C, 1270 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto crítico | (Extrapolada) 2093 K, 16 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusão | 2.19 kJ mol -1 · | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporização | 75,77 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 31,060 J · · mol -1 K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 1 (Fortemente óxido de base) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 0,82 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização | 1º: 403 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 2: 2632,1 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3: 3859,4 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atômico | 248 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 220 ± 21:00 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals raio | 303 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | cúbica de corpo centrado  | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | paramagnético | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistividade elétrica | (20 ° C) 128 Nco · m | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 58,2 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C) 1.300 m · s -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| O módulo de Young | 2.4 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa de módulo | 2,5 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 0,3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 0,216 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-17-7 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de rubídio | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
Rubídio é um elemento químico com o símbolo Rb e número atômico 37. Rubídio é um pano macio, branco-prateado metálico elemento do metal alcalino do grupo, com uma massa atômica de 85,4678. Rubídio elementar é altamente reactivo, com propriedades semelhantes às de outros elementos do Grupo 1 , tal como muito rápido oxidação em ar . Rubídio tem apenas um isótopo estável, 85 Rb, com o isótopo 87 Rb, que compõe quase 28% de rubídio que ocorre naturalmente, sendo ligeiramente radioativo com uma meia-vida de 49.000 milhões anos-mais de três vezes mais do que o estimado idade do universo .
Químicos alemães Robert Bunsen e Gustav Kirchhoff descobriu rubídio em 1861 pelo método recém-desenvolvido de espectroscopia de chama.
Compostos de rubídio têm várias aplicações químicas e eletrônicas. Rubídio metal é facilmente vaporizado e tem uma conveniente gama absorção espectral, tornando-se um alvo freqüente de laser de manipulação de átomos .
Rubídio não é conhecido por ser necessário para quaisquer organismos vivos . No entanto, como césio , rubídio iões são tratadas pelos organismos vivos de uma forma semelhante à de potássio iões, sendo feita activamente-se por plantas e por células de animais .
Características
Rubídio é muito macio, dúctil, metal branco-prateado. É o segundo mais electropositiva de metais alcalinos não radioactivos e derrete a uma temperatura de 39,3 ° C (102,7 ° F). Semelhante a outros metais alcalinos, rubídio metálico reage violentamente com a água, forma amálgamas com mercúrio e ligas com ouro , ferro , de césio , de sódio , e de potássio , mas não de lítio (apesar do facto de rubídio e lítio estão no mesmo grupo). Tal como acontece com potássio (que é um pouco menos reactivo) e de césio (que é ligeiramente mais reactivo), reacção de rubídio com água é geralmente suficientemente vigorosa para inflamar o hidrogénio gás que liberta. Rubídio, também tem sido relatado para inflamar espontaneamente no ar. Rubídio tem uma energia de ionização muito baixo de apenas 406 kJ / mol. Rubídio e potássio mostram uma cor púrpura muito semelhante no teste de chama, o que torna os métodos de espectroscopia necessário distinguir os dois elementos.
Compostos
Cloreto de rubídio (RbCl) é provavelmente o composto rubídio mais utilizado; é utilizado em bioquímica para induzir as células a tomar-se DNA , e como biomarcador, uma vez que é prontamente levado para substituir potássio, e ocorre apenas em pequenas quantidades em organismos vivos. Outros compostos de rubídio comuns são o corrosivo hidróxido de rubídio (RbOH), o material de partida para a maioria dos processos químicos à base de rubídio; carbonato de rubídio (Rb 2 CO 3), que é utilizado em alguns vidros ópticos, e sulfato de cobre rubídio, Rb 2 SO 4 · CuSO4 · 6H 2 O. Iodeto de rubídio de prata (I RbAg 4 5) tem o mais alto temperatura ambiente condutividade de qualquer conhecida cristal iónico, uma propriedade que está sendo explorada no filme fino baterias e outras aplicações.
Rubídio tem um número de óxidos, incluindo o monóxido de rubídio (Rb 2 O) a, R b e R 6 O 9 O 2, que formam se rubídio metal é exposta ao ar; rubídio em excesso de oxigénio dá o superóxido RBO 2. Rubídio forma sais com halogenetos, fazendo fluoreto de rubídio, cloreto de rubídio, brometo de rubídio, e iodeto de rubídio.
Isótopos
Apesar de rubídio é monoisotópico, que ocorre naturalmente rubídio é composto por dois isótopos: o 85 Rb estável (72,2%) eo 87 Rb radioactivos (27,8%). Rubídio Natural é radioativo com actividade específica de cerca de 670 Bq / g, suficiente para expor um significativamente filme fotográfico em 110 dias. Além de 85 Rb e 87 Rb, outros 24 isótopos ou rubídio produzidos sinteticamente são conhecidos, com tempos de meia de menos de 3 meses; a maioria destes são altamente radioativo e tem alguns usos.
Rubídio-87 tem uma meia-vida de 48,8 x 10 9 anos, o que é mais do que três vezes a idade do universo de 13,75 ± 0,11 x 10 9 anos, tornando-o um nuclide primordial. Ele prontamente substitui potássio em minerais , e é, portanto, bastante difundida. Rb tem sido utilizado extensivamente em datar rochas; 87 Rb decai para estável 87 Sr pela emissão de um negativo partícula beta. Durante cristalização fraccionada, Sr tende a concentrar-se em plagioclase, deixando Rb na fase líquida. Daí, a razão Rb / Sr residual no magma pode aumentar ao longo do tempo, resultando em rochas com elevados rácios de RB / Sr devido a progredir diferenciação. As maiores proporções (10 ou mais) ocorrem em pegmatitos. Se a quantidade inicial de Sr é conhecido ou pode ser extrapolada, em seguida, a idade pode ser determinada por medição do Rb e concentrações de Sr e da razão Sr 87 Sr / 86. As datas indicar a verdadeira idade dos minerais somente se as rochas não têm sido alterados posteriormente (ver namoro rubídio-estrôncio).
Rubídio-82, um dos isótopos não-naturais do elemento, é produzido pela captura de electrões decadência da estrôncio-82 com uma semi-vida de 25,36 dias. A decomposição subsequente do rubídio-82 com uma semi-vida de 76 segundos para estável krypton-82 acontece por emissão de pósitrons.
Ocorrência
Rubídio é o vigésimo terceiro elemento mais abundante na crosta da Terra, cerca de tão abundante como zinco e bastante mais comum do que o cobre . Ocorre naturalmente nos minerais leucite, pollucite, carnalite, e zinnwaldita, que contém até 1% do seu óxido. Lepidolite contém entre 0,3% e 3,5% de rubídio, e é a fonte comercial do elemento. Alguns potássio e minerais cloretos de potássio também conter o elemento em quantidades comercialmente significativas.
A água do mar contém uma média de 125 ug / L de rubídio em comparação com o valor muito mais elevado de potássio de 408 mg / L e o valor muito mais baixo de 0,3 ug / L para césio
Devido à sua grande raio iónico, rubídio é um dos " elementos incompatíveis ". Durante cristalização do magma, rubídio é concentrado em conjunto com o seu análogo de césio mais pesado na fase líquida e cristaliza passado. Portanto, os maiores depósitos de rubídio e césio são zona corpos de minério pegmatite formadas por este processo de enriquecimento. Como substitutos de rubídio de potássio na cristalização do magma, o enriquecimento é muito menos eficaz do que no caso de césio. Corpos de minério pegmatite zona contendo quantidades lavráveis de césio como pollucite ou os minerais de lítio lepidolita também são uma fonte para rubídio como um subproduto.
Duas fontes notáveis de rubídio são os ricos depósitos de pollucite em Bernic Lake, Manitoba, Canadá , eo rubicline ((Rb, K) AlSi 3 O 8) encontrados como impurezas em pollucite sobre o italiano ilha de Elba, com um teor de 17,5% de rubídio. Ambos estes depósitos são também fontes de césio .
Produção
Embora rubídio é mais abundante na crosta terrestre de césio, as aplicações limitadas e à falta de um mineral rico em rubídio limita a produção de compostos de rubídio a 2-4 toneladas por ano. Vários métodos estão disponíveis para a separação de potássio, rubídio, e césio. O cristalização fraccionada de um rubídio e césio alúmen (Cs, Rb) Al (SO 4) 2 · 12H 2 O rendimento depois de 30 passos subsequentes puro alúmen rubídio. Dois outros métodos são relatados, o processo e o processo chlorostannate ferrocianeto.
Durante vários anos na década de 1950 e 1960, um subproduto da produção de potássio chamado Alkarb era uma fonte principal de rubídio. Alkarb continha 21% de rubídio, sendo o restante de potássio e uma pequena fracção de césio. Hoje os maiores produtores de césio, como o Tanco Mine, Manitoba, Canadá, produzir rubídio como subproduto da pollucite.

História

Rubídio foi descoberto em 1861 por Robert Bunsen e Gustav Kirchhoff, em Heidelberg, na Alemanha, no mineral Lepidolite através da utilização de um espectroscópio. Devido às linhas vermelhas brilhantes do seu espectro de emissão, eles escolheram um nome derivado do latim palavra rubidus, que significa "vermelho escuro".
Rubídio está presente como um componente menor no lepidolita. Kirchhoff e Bunsen processadas 150 kg de uma lepidolite contendo apenas 0,24% de óxido de rubídio (Rb 2 O). Ambos os de potássio e formar sais insolúveis com rubídio ácido cloroplatínico, mas estes sais mostram uma ligeira diferença na solubilidade em água quente. Portanto, o rubídio menos solúvel hexacloroplatinato (Rb 2 PtCl 6) pode ser obtido pela cristalização fraccionada. Após redução do hexacloroplatinato com hidrogénio . Este processo rendeu 0,51 g de cloreto de rubídio para estudos posteriores. O primeiro isolamento em larga escala de compostos de césio e rubídio, realizada a partir de 44 mil litros de água mineral por Bunsen e Kirchhoff, rendeu, além de 7,3 gramas de cloreto de césio, também 9,2 gramas de cloreto de rubídio. Rubídio foi o segundo elemento, logo após de césio, de ser descoberto espectroscopicamente , apenas um ano após a invenção do espectroscópio por Bunsen e Kirchhoff.
Os dois cientistas utilizado o cloreto de rubídio assim obtido para estimar o peso atômico do novo elemento como 85,36 (o valor aceito atualmente é 85,47). Eles tentaram gerar rubídio elemental por eletrólise de cloreto de rubídio fundido, mas em vez de um metal, eles obtiveram uma substância homogênea azul, que "nem sob a olho nu nem sob o microscópio mostrou o menor traço de substância metálica." Atribuíram-lo como um subchloride (Rb 2 Cl); contudo, o produto era provavelmente um mistura coloidal de o cloreto de metal e rubídio. Numa segunda tentativa para produzir rubídio metálico, de Bunsen era capaz de reduzir o rubídio carbonizada por aquecimento tartarato de rubídio. Embora o rubídio foi destilada pirofórico, foi possível determinar a densidade e o ponto de fusão de rubídio. A qualidade da pesquisa feita na década de 1860 pode ser avaliada pelo fato de que sua determinada densidade difere menos de 0,1 g / cm 3 eo ponto de fusão por menos de 1 ° C a partir dos valores atualmente aceitos.
A ligeira radioatividade de rubídio foi descoberto em 1908, mas antes que a teoria de isótopos foi criada na década de 1910 ea atividade baixa devido à meia-vida longa de acima de 10 10 anos fez interpretação complicado. A decadência agora comprovada de 87 Rb para estável 87 Sr através decaimento beta ainda estava em discussão no final de 1940.
Rubídio tinha valor industrial mínima antes da década de 1920. Desde então, o uso mais importante de rubídio tem sido na pesquisa e desenvolvimento, principalmente em aplicações de produtos químicos e eletrônicos. Em 1995, foi utilizado o rubídio-87 para produzir um Condensado de Bose-Einstein, para que os descobridores, Eric Allin Cornell, Carl Wieman e Edwin Wolfgang Ketterle, ganhou o 2001 Prêmio Nobel de Física .
Aplicações

Compostos de rubídio são por vezes usados em fogos de artifício para dar-lhes uma cor roxa. Rubídio, também tem sido considerada para utilização numa gerador termoeléctrico usando o princípio magneto, onde iões rubídio são formados por calor a alta temperatura e passados através de um campo magnético. Estes conduta eletricidade e agir como um armadura de um gerador gerando assim um corrente elétrica. Rubídio, particularmente vaporizado 87 Rb, é uma das espécies atómicas mais comumente utilizados para empregues arrefecimento a laser e Condensação de Bose-Einstein. Suas características desejáveis para esta aplicação incluem a pronta disponibilidade de barato diodo laser no relevante comprimento de onda, e as temperaturas moderadas necessárias para obter as pressões de vapor substancial.
Rubídio foi usado para polarizar 3 Ele, produzindo volumes de gás magnetizado 3 Ele, com os spins nucleares alinhadas em direção a uma determinada direção no espaço, ao invés de aleatoriamente.
Vapor de rubídio é opticamente bombeado por um laser eo Rb polariza polarizado 3 Ele através da interação hiperfina.
Tal células 3, ele spin-polarizada estão se tornando popular para medidas de polarização de nêutrons e para a produção de feixes de neutrões polarizadas para outros fins.
O elemento de ressonância em relógios atômicos utiliza o estrutura hiperfina de níveis de energia de rubídio, tornando rubídio útil para o sincronismo de alta precisão, e é usado como o principal componente das referências de frequência secundárias (osciladores de rubídio) para manter a precisão de freqüência em transmissores site de celulares e outros eletrônicos de transmissão, redes e equipamentos de teste. Estes padrões de rubídio são muitas vezes utilizados com GPS para produzir um "padrão de frequência primária", que tem uma maior precisão e é menos caro do que os padrões de césio. Tais padrões de rubídio são muitas vezes produzidos em massa para a telecomunicação indústria.
Outros usos potenciais ou atuais de rubídio incluem um fluido de trabalho em turbinas de vapor, como um getter em tubos de vácuo, e como um componente fotocélula. Rubídio também é usado como um ingrediente em tipos especiais de vidro, na produção de superóxido por queima em oxigénio , no estudo de potássio canais iônicos em biologia, e como o vapor para fazer atômica magnetômetros. Em particular, 87 Rb está actualmente a ser usado, com outros metais alcalinos, no desenvolvimento de troca de spin-livre relaxamento (servo) magnetômetros.
Rubídio-82 é utilizado para A tomografia por emissão de pósitrons. Rubídio é muito semelhante ao de potássio e, por conseguinte, o tecido com alto teor de potássio também irá acumular o rubídio radioactivos. Uma das principais utilizações é em cintilografia de perfusão miocárdica. A meia-vida muito curta de 76 segundo faz com que seja necessário para produzir o rubídio-82 da deterioração da estrôncio-82 próximo do paciente. Como resultado das mudanças no barreira hemato-encefálica em tumores cerebrais, rubídio recolhe mais em tumores cerebrais do que o tecido cerebral normal, permitindo a utilização de radioisótopos de rubídio-82 na medicina nuclear para localizar e tumores cerebrais imagem.
Rubídio foi testado para a influência sobre a psicose maníaco-depressiva e depressão. Pacientes em diálise que sofrem de depressão apresentam uma depleção em rubídio e, portanto, um suplemento pode ajudar durante a depressão. Em alguns ensaios, o rubídio foi administrado como cloreto de rubídio com até 720 mg por dia durante 60 dias.
Precauções e efeitos biológicos
Rubídio reage violentamente com a água e pode causar incêndios. Para garantir a segurança e pureza, este metal é normalmente mantida sob uma seca óleo mineral ou selados em ampolas de vidro sob uma atmosfera inerte. Formas de rubídio peróxidos sobre a exposição, mesmo a pequena quantidade de difusão de ar no óleo, e é, portanto, sujeitas a precauções peróxido semelhantes como o armazenamento de materiais metálicos de potássio .
Rubídio, como sódio e potássio, quase sempre tem um estado de oxidação quando dissolvido em água, incluindo a sua presença em todos os sistemas biológicos. O corpo humano tende a tratar iões Rb +, como se fossem iões de potássio, e, por conseguinte, concentra-se no corpo de rubídio de fluido intracelular (ou seja, no interior das células). Os iões não são particularmente tóxicos; uma pessoa de 70 quilos contém em média 0,36 g de rubídio, e um aumento neste valor de 50 a 100 vezes não revelaram efeitos negativos nas pessoas de teste. O meia-vida biológica de rubídio foi medida em seres humanos como 31-46 dias. Embora uma substituição parcial de potássio por rubídio é possível, ratos com mais de 50% do seu potássio substituído no tecido muscular morreu.

