
Promécio
Informações de fundo
Esta seleção Wikipedia está offline disponível a partir de Crianças SOS, para distribuição no mundo em desenvolvimento. Antes de decidir sobre o patrocínio de uma criança, por que não aprender sobre as diferentes instituições de caridade de patrocínio primeiro ?
| Promécio | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
61 Pm | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Aparência | ||||||||||||||||||||||||||||
| metálico | ||||||||||||||||||||||||||||
| Propriedades gerais | ||||||||||||||||||||||||||||
| Nome, símbolo, número | promethium, Pm, 61 | |||||||||||||||||||||||||||
| Pronúncia | / p r ɵ m Eu θ Eu ə m / pro- MEE -thee-əm | |||||||||||||||||||||||||||
| Categoria elemento | lantanídeos | |||||||||||||||||||||||||||
| Grupo, período, bloco | n / D, 6, f | |||||||||||||||||||||||||||
| Peso atômico padrão | [145] | |||||||||||||||||||||||||||
| Configuração eletrônica | [ Xe ] 6s 2 4f 5 2, 8, 18, 23, 8, 2 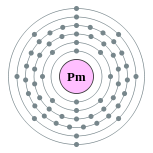 | |||||||||||||||||||||||||||
| História | ||||||||||||||||||||||||||||
| Descoberta | Chien Shiung Wu, Emilio Segrè, Hans Bethe (1942) | |||||||||||||||||||||||||||
| Primeiro isolamento | Charles D. Coryell, Jacob A. Marinsky, Lawrence E. Glendenin, Harold G. Richter (1945) | |||||||||||||||||||||||||||
| Nomeado por | Graça Maria Coryell (1945) | |||||||||||||||||||||||||||
| Propriedades físicas | ||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||
| Densidade (perto RT) | 7,26 g cm -3 · | |||||||||||||||||||||||||||
| Ponto de fusão | 1315 K , 1042 ° C, 1908 ° F | |||||||||||||||||||||||||||
| Ponto de ebulição | 3273 K, 3000 ° C, 5432 ° F | |||||||||||||||||||||||||||
| Calor de fusão | 7.13 kJ mol -1 · | |||||||||||||||||||||||||||
| Calor de vaporização | 289 kJ mol -1 · | |||||||||||||||||||||||||||
| Propriedades atômicas | ||||||||||||||||||||||||||||
| Estados de oxidação | 3 (moderadamente óxido de base) | |||||||||||||||||||||||||||
| Eletronegatividade | ? 1,13 (escala de Pauling) | |||||||||||||||||||||||||||
| Energias de ionização | 1º: 540 kJ · mol -1 | |||||||||||||||||||||||||||
| Segunda: 1050 kJ mol -1 · | ||||||||||||||||||||||||||||
| 3: 2150 kJ · mol -1 | ||||||||||||||||||||||||||||
| Raio atômico | 183 pm | |||||||||||||||||||||||||||
| O raio de covalência | 199 pm | |||||||||||||||||||||||||||
| Miscelânea | ||||||||||||||||||||||||||||
| A estrutura de cristal | hexagonal  | |||||||||||||||||||||||||||
| Ordenamento magnético | paramagnético | |||||||||||||||||||||||||||
| Resistividade elétrica | ( RT) est. 0,75 μΩ · m | |||||||||||||||||||||||||||
| Condutividade térmica | 17.9 W · m -1 · K -1 | |||||||||||||||||||||||||||
| Expansão térmica | ( RT) (α, poli) est. 11 mm / (m · K) | |||||||||||||||||||||||||||
| O módulo de Young | (Α forma) est. 46 GPa | |||||||||||||||||||||||||||
| Módulo de cisalhamento | (Α forma) est. 18 GPa | |||||||||||||||||||||||||||
| Massa de módulo | (Α forma) est. 33 GPa | |||||||||||||||||||||||||||
| Rácio de Poisson | (Α forma) est. 0,28 | |||||||||||||||||||||||||||
| Número de registo CAS | 7440-12-2 | |||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | ||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de promécio | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
Promethium, originalmente Prometheum, é um elemento químico com o símbolo Pm e número atômico 61. Todos os seus isótopos são radioactivos; é um dos dois únicos tais elementos que são seguidos na tabela periódica por elementos com formas estáveis, uma distinção compartilhada com tecnécio . Quimicamente, o promécio é um lantanídeo , que forma sais quando combinados com outros elementos. Promethium mostra apenas um estado de oxidação estável de três; no entanto, podem existir algumas dois compostos.
Em 1902, Bohuslav Brauner sugeriu que havia um elemento com propriedades intermediárias entre aquelas dos conhecidos elementos de neodímio (60) e samário (62); isto foi confirmado em 1914 por Henry Moseley que, tendo medido os números atômicos de todos os elementos então conhecidos, descobriram que não havia elementos com número atômico 61. Em 1926, um italiano e um grupo americano alegou ter isolado uma amostra do elemento 61; tanto "descobertas" foram logo provou ser falsa. Em 1938, durante um experimento nuclear realizado no Universidade do Estado de Ohio, em alguns nuclides radioativos foram produzidos que certamente não eram radioisótopos do neodímio ou samário, mas havia uma falta de prova química que elemento 61 foi produzida, ea descoberta não foi geralmente reconhecido. Promethium foi produzido pela primeira vez e caracterizada pelo Oak Ridge National Laboratory, em 1945, pela separação e análise dos produtos de fissão de urânio combustível irradiado em um reator de grafite. Os descobridores propôs o nome "Prometheum" (a ortografia foi posteriormente alterado), derivado Prometeu, o titã da mitologia grega que roubou o fogo do Olimpo e trouxe-o para baixo para os seres humanos, para simbolizar "tanto a ousadia ea eventual utilização abusiva do intelecto da humanidade." No entanto, uma amostra de metal foi feita apenas em 1963.
Há duas fontes possíveis para promethium natural: raras decai dos recursos naturais európio -151 (produzindo promethium-147) e urânio (vários isótopos). Existem aplicações práticas apenas para compostos químicos de promécio-147, que são utilizados em tinta luminosa, pilhas atômicas e dispositivos de medição de espessura, embora promethium-145 é o isótopo mais estável promethium. Desde promethium natural é muito escassa, o elemento é normalmente sintetizado bombardeando o urânio-235 ( urânio enriquecido) com nêutrons térmicos para produzir promethium-147.
Propriedades
Propriedades físicas
Um átomo de promethium tem 61 elétrons, organizados no configuração [ Xe ] 6s 4f 5 2. Em compostos de formação, o átomo perde seus dois elétrons ultraperiféricas e um dos elétrons-4F, que pertence a um subnível aberto. Raio atómico do elemento é o terceiro maior entre todos os lantanídeos, mas é apenas ligeiramente maior do que as dos elementos vizinhos. É a única exceção à tendência geral da contração dos átomos com aumento de raio atômico (causada pelo contracção dos lantanídeos) que não é causada pela cheia (ou meio-cheio) 4f-subcamada.
Muitas propriedades de promethium dependem de sua posição entre lantanídeos e são intermediárias entre as de neodímio e samário. Por exemplo, o ponto de fusão, os três primeiros energia de ionização, e a energia de hidratação são maiores do que os de neodímio e inferiores às de samário; Do mesmo modo, a estimativa para o ponto de ebulição, iónica (Pm 3+) de raio, e de calor padrão de formação de gás monoatômico são maiores do que os de samário e menos aqueles de neodímio.
Promécio tem um embalado (DHCP) estrutura dobro perto hexagonal e uma dureza de 63 kg / mm 2. Esta forma alfa de baixa temperatura converte em uma versão beta, cúbico (BCC) fase de corpo centrado após aquecimento a 890 ° C.
Propriedades químicas e compostos
Promécio pertence à grupo de cério de lantanídeos e é quimicamente muito semelhante aos elementos vizinhos. Devido à sua instabilidade, estudos químicos de promécio são incompletos. Mesmo que alguns compostos foram sintetizados, eles não são totalmente estudado; em geral, tendem a ser rosa ou vermelho em cor. Tratamento de soluções ácidas contendo iões Pm 3+ com amoníaco resulta numa castanho claro sedimento gelatinoso de hidróxido, Pm (OH) 3, que é insolúvel em água. Quando dissolvido em ácido clorídrico, um sal amarelo, solúvel em água, PMCL 3, é produzido; Da mesma forma, quando dissolvido em ácido nítrico, nitrato de resultados, Pm (NO 3) 3. O último também é bem solúvel; quando seca, ela forma cristais cor de rosa, semelhante à de Nd (NO3) 3. A configuração de electrões para Pm 3+ é [Xe] 4f 4, e a cor do ião é cor de rosa. O símbolo termo estado fundamental é de 5 I 4. O sulfato é pouco solúvel, como os outros sulfatos grupo de cério. Parâmetros celulares foram calculados para a sua octahydrate; eles levam a conclusão de que a densidade de Pm 2 (SO 4) 3 · 8 H2O é 2,86 g / cm3. O oxalato, Pm 2 (C 2 O 4) 3 · 10 H2O, tem a menor solubilidade de todos os oxalatos lantanídeos.
Ao contrário do nitrato, a óxido é semelhante ao do sal de samário correspondente e não o sal de neodímio. Como sintetizado, por exemplo, por aquecimento do oxalato, que é um pó branco ou de cor lavanda com estrutura desordenada. Este pó cristaliza numa rede cúbica após aquecimento a 600 ° C. Além disso recozimento a 800 ° C e, em seguida, a 1750 ° C de forma irreversível transforma-lo para uma monoclinic e fases hexagonais, respectivamente, e as duas últimas fases podem ser interconvertidos, ajustando o tempo e temperatura de recozimento.
| Fórmula | simetria | grupo espacial | Não | Símbolo Pearson | A (pm) | b (pm) | c (h) | Z | densidade, g / cm 3 |
|---|---|---|---|---|---|---|---|---|---|
| α-Pm | dhcp | P6 3 / mmc | 194 | HP4 | 365 | 365 | 1165 | 4 | 7,26 |
| β-Pm | bcc | Fm 3 m | 225 | CF4 | 410 | 410 | 410 | 4 | 6.99 |
| Pm 2 O 3 | cúbico | Ia 3 | 206 | cI80 | 1099 | 1099 | 1099 | 16 | 6,77 |
| Pm 2 O 3 | monoclinic | C2 / m | 12 | MS30 | 1422 | 365 | 891 | 6 | 7.40 |
| Pm 2 O 3 | hexagonal | P 3 M1 | 164 | hP5 | 380,2 | 380,2 | 595,4 | 1 | 7,53 |
Formas promethium apenas um estado de oxidação estável, 3, sob a forma de iões; este está em linha com outros lantanídeos. De acordo com a sua posição na tabela periódica , o elemento não pode ser prevista de modo a formar dois ou quatro estável estados de oxidação; tratamento de compostos químicos que contenham iões Pm 3+ com oxidantes fortes ou agentes redutores mostrou que o ião não é facilmente oxidado ou reduzido.
| Fórmula | cor | coordenação número | simetria | grupo espacial | Não | Símbolo Pearson | p.f. (° C) |
|---|---|---|---|---|---|---|---|
| PmF 3 | Purple-rosa | 11 | hexagonal | P 3 c1 | 165 | hP24 | 1338 |
| PMCL 3 | Lavanda | 9 | hexagonal | P6 3 / mc | 176 | HP8 | 655 |
| PMBR 3 | Vermelho | 8 | orthorhombic | Cmcm | 63 | oS16 | 624 |
| α-PMI 3 | Vermelho | 8 | orthorhombic | Cmcm | 63 | oS16 | α → β |
| β-PMI 3 | Vermelho | 6 | rhombohedral | R3 | 148 | hR24 | 695 |
Isótopos
Promethium é o único dos lantanídeos e um dos dois únicos elementos entre o primeiro 82 que não tem estável (ou mesmo de longa duração) isótopos; este é um resultado de um efeito do que ocorre raramente modelo da gota de líquido e estabilidades de isótopos do elemento vizinho; é também menos estável do elemento do primeiro 84. Os produtos de decaimento são neodímio e samário isótopos (promécio-146 decai para ambos, os isótopos mais leves geralmente a via de neodímio decadência de pósitrons e a captura eletrônica, e os isótopos mais pesados para samário via decaimento beta). Promécio isômeros nucleares pode decair para outros isótopos promethium e um isótopo (145 Pm) tem um modo de decaimento alfa muito raro praseodímio .
O isótopo mais estável do elemento é o promécio-145, que tem uma actividade específica de 940 Ci (35 TBq) / g e uma meia-vida de 17,7 anos através captura de elétrons. Porque ele tem 84 nêutrons (dois a mais que 82, que é um número mágico o que corresponde a uma configuração estável de neutrões), que podem emitir uma partícula alfa (que tem 2 nêutrons) para formar praseodímio-141 com 82 nêutrons. Assim, é o único isótopo promécio com uma observado experimentalmente decaimento alfa. Sua meia-vida parcial para o decaimento alfa é de cerca de 6,3 × 10 9 anos, ea probabilidade relativa de um núcleo 145 Pm a decadência dessa forma é 2,8 × 10 -7%. Vários outros Pm isótopos (144 Pm, 146 Pm, 147 Pm etc.) também têm uma liberação de energia positiva para decaimento alfa; os decaimentos alfa estão previstos para ocorrer, mas não foram observadas.
O elemento também tem 18 isômeros nucleares, com números de massa de 133-142, 144, 148, 149, 152, e 154 (alguns números de massa têm mais de um isômero). O mais estável deles é o promécio-148m, com uma semi-vida de 43,1 dias; isso é mais do que as meias-vidas dos estados fundamentais de todos os isótopos promethium, com exceção apenas para promethium-143-147 (note que promethium-148M tem uma meia-vida mais longa do que o estado do solo, o promécio-148).
Ocorrência

Em 1934, Willard Libby encontrou atividade beta fraco em neodímio puro, o que foi atribuído a uma meia-vida de mais de 10 12 anos. Quase 20 anos mais tarde, foi alegado que o elemento ocorre em neodímio natural em equilíbrio em quantidades inferiores a 10 -20 gramas de promécio por um grama de neodímio. No entanto, estas observações foram refutadas por investigações mais recentes, porque para todos os sete que ocorrem naturalmente isótopos de neodímio, nenhum decaimento beta de solteiro (que podem produzir nuclides promethium) são proibidos pela conservação de energia. Em particular, medidas cuidadosas de massas atômicas mostram que a diferença de massa 150 nd- 150 Pm é negativo (-87 keV), que impede absolutamente o decaimento beta única de 150 Nd 150 Pm.
Ambos os isótopos de európio natural têm maior excessos de massa do que somas de aqueles de suas filhas alfa potenciais que mais de uma partícula alfa; portanto, eles (estável na prática) pode alfa decadência. Pesquisa da Laboratori Nazionali del Gran Sasso mostrou que európio-151 experimentalmente decai para o promécio-147 com a semi-vida de 5 × 10 18 anos. Tem sido demonstrado que európio é "responsável" durante cerca de 12 gramas de promécio na crosta terrestre. Alfa decai para európio-153 não foi encontrado ainda, e sua meia-vida calculada teoricamente é tão elevada (devido à baixa energia de decaimento) que este processo vai provavelmente nunca ser observado.
Finalmente, o promécio podem ser formados na natureza como um produto de fissão espontânea de urânio-238. Apenas quantidades vestigiais pode ser encontrado em minérios que ocorrem naturalmente: uma amostra de pitchblende foi encontrado para conter o promécio a uma concentração de quatro partes por quintillion (10 18) de massa. O urânio é, portanto, "responsável" por 560 g promethium na crosta da Terra .
Promécio também foi identificada no espectro da estrela HR 465 em Andromeda; também tem sido encontrada em HD 101.065 ( Estrela de Przybylski) e HD 965. Devido à semi-vida curta de isótopos de promécio, eles devem ser formadas perto da superfície dessas estrelas.
História
Procura elemento 61
Em 1902, o químico checo Bohuslav Brauner descobriu que a diferença entre o neodímio e samário é o maior de todos os vizinhos lantanídeos pares; como conclusão, ele sugeriu que havia um elemento com propriedades intermediárias entre eles. Essa previsão foi apoiado em 1914 por Henry Moseley que, tendo descoberto que o número atômico era uma propriedade experimentalmente mensurável de elementos, encontrei alguns números atômicos tinha nenhum elemento para corresponder: as lacunas foram 43, 61, 72, 75, 85 e 87. Com o conhecimento de uma lacuna na tabela periódica vários grupos começaram a procurar o elemento previsto entre outras terras raras no ambiente natural.
A primeira alegação de uma descoberta foi publicado por Luigi Rolla e Lorenzo Fernandes de Florença, Itália. Após a separação de uma mistura de alguns elementos de terras raras nitrato de concentrado a partir da brasileira mineral monazita por cristalização fracionada, eles produziram uma solução contendo principalmente samário. Esta solução deu espectros de raios-x atribuída a samário e elemento 61. Em homenagem a sua cidade, deram o nome de elemento 61 "florentium." Os resultados foram publicados em 1926, mas os cientistas afirmaram que os experimentos foram realizados em 1924. Também em 1926, um grupo de cientistas da Universidade de Illinois em Urbana-Champaign, Smith Hopkins e Len Yntema publicou a descoberta do elemento 61. Eles nomeou-o "illinium", após a universidade. Ambas estas descobertas relatadas demonstraram ser errada, porque a linha de espectro que "corresponde" ao elemento 61 foi idêntico ao do didímio; as linhas pensado para pertencer ao elemento 61 acabou por pertencer a algumas impurezas (bário, cromo e platina).
Em 1934, Josef Mattauch finalmente formulado a isobar regra. Uma das consequências indiretas da era essa regra era esse elemento 61 foi incapaz de formar isótopos estáveis. Em 1938, um experimento nuclear foi conduzido por HB Law et al. A Universidade do Estado de Ohio. Os radionuclídeos produzidos certamente não foram radioisótopos do neodímio ou samário, eo nome "cyclonium" foi proposto, mas houve uma falta de prova elemento químico que 61 foi produzida ea descoberta, em grande parte não reconhecida.
Descoberta e síntese de promethium de metal
Promethium foi produzido pela primeira vez e caracterizada pelo Oak Ridge National Laboratory (Clinton Laboratories naquela época) em 1945 por Jacob A. Marinsky, Lawrence E. Glendenin e Charles D. Coryell por separação e análise dos produtos de fissão de Urânio combustível irradiados na grafite reactor; no entanto, ser demasiado ocupado com a investigação militar-relacionado durante a Segunda Guerra Mundial , eles não anunciar a sua descoberta até 1947. O nome original proposto era "clintonium", após o laboratório onde o trabalho foi realizado; no entanto, o nome "Prometheum" foi sugerido por Grace Mary Coryell, a esposa de um dos descobridores. É derivado do Prometeu, o titã da mitologia grega que roubou o fogo do Olimpo e trouxe-o para baixo para os seres humanos e simboliza "tanto a ousadia ea eventual utilização abusiva do intelecto a humanidade." A ortografia foi então alterado para "promethium," como este foi mais perto de acordo com outros metais.

Jacob A. Marinsky

Lawrence E. Glendenin

Charles D. Coryell
Em 1963, o promécio (III), fluoreto foi usado para fazer o promécio de metal. Provisoriamente purificado de impurezas, de samário, neodímio, e amerício, ele foi colocado em uma tântalo cadinho que foi localizado em outro cadinho de tântalo; o cadinho externo contido lítio metálico (10 vezes em excesso em comparação com o promécio). Depois de criar um vácuo, os produtos químicos foram misturados para produzir metal de promécio:
- PmF 3 + 3 + Li → Pm 3 LiF
A amostra promécio produzido foi usado para medir algumas das propriedades do metal, tais como o seu ponto de fusão .
Em 1963, os métodos de troca iônica foram usados em ORNL para preparar cerca de dez gramas de promécio a partir de resíduos de tratamento de combustível do reator nuclear.
Hoje em dia, promécio ainda é recuperado dos subprodutos da fissão do urânio; ele também pode ser produzido bombardeando 146 Nd com neutrons , transformando-o em 147 Nd que decai em 147 Pm através de decaimento beta com uma meia-vida de 11 dias.
Produção
Os métodos de produção dos diferentes isótopos variar, e apenas para que o promécio-147 é dado, porque é o único isótopo com aplicações industriais. Promethium-147 é produzido em grandes quantidades (em comparação com outros isótopos) bombardeando o urânio-235 com nêutrons térmicos. A saída é relativamente elevada, em 2,6% do produto total. Uma outra maneira de produzir o promécio-147 é através de neodímio-147, que decai para o promécio-147 com uma meia-vida curta. Neodímio-147 pode ser obtida quer bombardeando enriquecido neodímio-146 com nêutrons térmicos ou bombardeando um alvo carboneto de urânio com prótons energéticos em um acelerador de partículas. Outro método consiste em bombardear urânio-238 com neutrões rápidos para causar fissão rápido, o que, entre vários produtos de reacção, cria promethium-147.
Quanto mais cedo a década de 1960, Oak Ridge National Laboratory poderia produzir 650 gramas de promécio por ano e só foi de grande volume facilidade síntese do mundo. Produção Gram-escala de promethium foi descontinuado em os EUA no início de 1980, mas possivelmente será retomado após 2010 no Isotope Reactor de Alto Fluxo. Atualmente, a Rússia é o único país produtor promethium-147 em uma escala relativamente grande.
Aplicações
Mais promécio é utilizado apenas para fins de pesquisa, excepto para o promécio-147, que pode ser encontrado laboratórios fora. Obtém-se como o óxido ou cloreto, em quantidades de miligrama. Este isótopo não emite raios gama, e a sua radiação tem uma profundidade de penetração relativamente reduzida em questão e uma meia-vida relativamente longa.
Algumas luzes de sinalização usar um tinta luminosa, contendo um fósforo que absorve a radiação beta emitida por promécio-147 e emite luz. Este isótopo não provoca o envelhecimento da substância fosforescente, como emissores alfa fazer, e, por conseguinte, a emissão de luz é estável durante alguns anos. Originalmente, o rádio -226 foi usado para o efeito, mas foi posteriormente substituída por promécio-147 e trítio (hidrogênio-3). Promethium podem ser favorecidos em detrimento de trítio para razões de segurança.
Em pilhas atômicas, as partículas beta emitidas pelo promécio-147 são convertidos em corrente elétrica imprensando uma pequena fonte Pm entre duas placas de semicondutores. Estas baterias têm uma vida útil de cerca de cinco anos. A bateria baseada em promethium primeiro foi montado em 1964 e gerou "alguns miliwatts de potência a partir de um volume de cerca de 2 polegadas cúbicas, incluindo blindagem".
Promécio também é utilizado para medir a espessura dos materiais, avaliando a quantidade de radiação de uma fonte de promécio que passa através da amostra. Tem possíveis utilizações futuras em fontes de raios-X portáteis, e como o calor ou de energia de fontes auxiliares para sondas espaciais e satélites (embora o emissor alfa plutônio-238 tornou-se padrão para a maioria dos usos relacionados com o espaço-exploração).
Precauções
O elemento, como outros lantanídeos, não tem nenhum papel biológico. Promethium-147 pode emitir Raios-X durante o seu decaimento beta, que são perigosos para todas as formas de vida. Interações com pequenas quantidades de promécio-147 não são perigosos se foram tomadas certas precauções. Em geral, luvas, capas de calçados, óculos de segurança, e uma camada externa de vestuário de protecção facilmente removido deve ser usado.
Não se sabe o que os órgãos de pessoas são afectadas por interacção com o promécio; um possível candidato é a tecidos ósseos. Selado promethium-147 não é perigoso. No entanto, se a embalagem estiver danificada, em seguida, o promécio se torna perigoso para o ambiente e os seres humanos. Se a contaminação radioativa é encontrado, a área contaminada deve ser lavada com água e sabão, mas, apesar de promethium afeta principalmente a pele, a pele não devem ser desgastados. Se um vazamento promethium for encontrado, a área deve ser identificado como perigoso e evacuados, e os serviços de emergência deve ser contactado. Sem perigos de promethium lado da radioatividade são conhecidos.
