Bismuto
Você sabia ...
Crianças SOS oferecem um download completo desta seleção para as escolas para uso em escolas intranets. Clique aqui para mais informações sobre Crianças SOS.
| Bismuto | |||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
83 Bi | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||||||||||||||||
prata brilhante  | |||||||||||||||||||||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | bismuto, Bi, 83 | ||||||||||||||||||||||||||||||||||||||||||
| Pronúncia | / b ɪ z m ə θ / BIZ -məth | ||||||||||||||||||||||||||||||||||||||||||
| Categoria Metallic | metais de transição pós- | ||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | 15 (pnictogens), 6, p | ||||||||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | 208,98040 (1) | ||||||||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Xe ] 4f 14 5d 10 6s 2 6p 3 2, 8, 18, 32, 18, 5 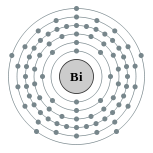 | ||||||||||||||||||||||||||||||||||||||||||
| História | |||||||||||||||||||||||||||||||||||||||||||
| Descoberta | Claude François Geoffroy (1753) | ||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 9,78 g cm -3 · | ||||||||||||||||||||||||||||||||||||||||||
| Líquido densidade no pf | 10,05 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 544,7 K , 271,5 ° C, 520,7 ° F | ||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 1837 K, 1564 ° C, 2847 ° F | ||||||||||||||||||||||||||||||||||||||||||
| Calor de fusão | 11.30 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||
| Calor de vaporização | 151 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 25.52 J · · mol -1 K -1 | ||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 5, 4, 3, 2, 1 (Moderadamente ácida óxido) | ||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 2,02 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||
| Energias de ionização ( Mais) | 1º: 703 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||
| 2: 1610 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||
| 3: 2466 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||
| Raio atômico | 156 pm | ||||||||||||||||||||||||||||||||||||||||||
| O raio de covalência | 148 ± 16:00 | ||||||||||||||||||||||||||||||||||||||||||
| Van der Waals raio | 207 pm | ||||||||||||||||||||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | rhombohedral  | ||||||||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | diamagnetic | ||||||||||||||||||||||||||||||||||||||||||
| Resistividade elétrica | (20 ° C) 1,29 μΩ · m | ||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 7,97 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||
| Expansão térmica | (25 ° C) de 13,4 pM · · K -1 m -1 | ||||||||||||||||||||||||||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C) 1790 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||
| O módulo de Young | 32 GPa | ||||||||||||||||||||||||||||||||||||||||||
| Módulo de cisalhamento | 12 GPa | ||||||||||||||||||||||||||||||||||||||||||
| Massa de módulo | 31 GPa | ||||||||||||||||||||||||||||||||||||||||||
| Rácio de Poisson | 0.33 | ||||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 2.25 | ||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 94,2 MPa | ||||||||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-69-9 | ||||||||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de bismuto | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
Bismuto é um elemento químico com o símbolo Bi e número atômico 83. Bismuto, um pentavalente pobre metal, assemelha-se quimicamente o arsênico e antimônio . Bismuto elementar pode ocorrer naturalmente, embora seus sulfureto e forma de óxido importantes minérios comerciais. O elemento livre é de 86% da densidade do chumbo . É um metal frágil com uma cor branco prateado quando recém-produzido, mas é muitas vezes visto no ar com um tom rosa devido à superfície oxidação. Bismuto é o mais naturalmente diamagnetic e tem um dos mais baixos valores de condutividade térmica entre os metais.
Metais bismuto foi conhecido desde os tempos antigos, embora até o século 18 foi muitas vezes confundida com chumbo e estanho, que partilham algumas propriedades físicas. A etimologia é incerta, mas possivelmente vem de ismid bi árabe, o que significa que tem as propriedades de antimônio ou palavras alemãs Weisse masse ou wismuth ("massa branca"), traduzido em meados do século XVI ao Nova bisemutum Latina.
Bismuto tem sido considerada como o elemento mais alto atômico em massa, isto é estável. No entanto, descobriu-se recentemente a ser ligeiramente radioactivos: a sua única isótopo primordial bismuto-209 alfa decai com uma metade de vida de mais de um bilhão de vezes a estimativa idade do universo .
Compostos de bismuto são responsáveis por cerca de metade da produção de bismuto. Eles são utilizados em produtos cosméticos, pigmentos, e alguns produtos farmacêuticos, nomeadamente Pepto-Bismol. Bismuto tem anormalmente baixo toxicidade para um metal pesado. Como a toxicidade de chumbo tornou-se mais evidente nos últimos anos, há uma crescente utilização de ligas de bismuto (actualmente cerca de um terço da produção de bismuto) como um substituto para o chumbo.
História
O nome de bismuto é de ca. 1660s, e é de etimologia incerta. É um dos 10 primeiros metais de ter sido descoberto. Bismuth aparece na década de 1660, a partir obsoleto alemão Bismuth, Wismut, Wissmuth (início do século 16); talvez relacionada com Old High German hwiz ("branco"). O Nova bisemutum Latina (devido a Georgius Agricola, que latinizado muitos mineração alemão e palavras técnicas) é do Wismuth alemão, talvez a partir de weiße Masse, "massa branca". O elemento estava confuso nos primeiros tempos com estanho e chumbo por causa de sua semelhança com esses elementos. Bismuto é conhecido desde os tempos antigos, de modo que ninguém pessoa é creditado com sua descoberta. Agricola, em De Natura Fossilium (ca. 1546) afirma que o bismuto é um metal distinta em uma família de metais incluindo estanho e chumbo. Este baseou-se na observação dos metais e as suas propriedades físicas. Mineiros na era da alquimia também deu bismuto do argenti nome tectum, ou "prata sendo feito," no sentido de prata ainda em processo de ser formado no interior da Terra.
Começando com Johann Heinrich Pott, em 1738, Carl Wilhelm Scheele e Torbern Olof Bergman a distinção de chumbo e bismuto tornou-se clara e Claude François Geoffroy demonstraram em 1753 que este metal é diferente de chumbo e de estanho. Bismuto também era conhecido pelos Incas e usados (juntamente com o cobre e estanho habitual) em um especial liga de bronze para facas.
Características


Características físicas
O bismuto é um metal frágil com um branco, cor-de-rosa-prata, que ocorrem frequentemente na sua forma nativa, com uma iridescente manchas de óxido mostrando muitas cores de amarelo para azul. A espiral, estrutura em degraus da escada-de cristais de bismuto é o resultado de uma taxa de crescimento mais elevada em torno das arestas exteriores do que nas extremidades internas. As variações na espessura da camada de óxido que se forma sobre a superfície do cristal causa a diferentes comprimentos de onda de luz para interferir após reflexão, exibindo, assim, um arco-íris de cores. Quando queimado em oxigênio , bismuto queimaduras com um azul chama e suas formas de óxido amarelo fumos. Sua toxicidade é muito mais baixa do que a de seus vizinhos na tabela periódica , como o chumbo, antimônio , e polônio .
Nenhum outro metal é verificado para ser mais naturalmente diamagnético que o bismuto. ( Superdiamagnetism é um fenômeno físico diferente.) De qualquer metal, tem um dos mais baixos valores de condutividade térmica (depois de manganês , e talvez Neptúnio e plutónio ) ea maior Coeficiente Hall. Ele tem uma alta resistência eléctrica . Quando depositado em camadas suficientemente finas sobre um substrato, o bismuto é um semicondutor , em vez de um pobre metal.
Bismuto elementar é uma das poucas substâncias de que a fase líquida é mais densa do que a fase sólida (sendo o exemplo mais conhecido de água). Bismuto expande 3,32% em solidificação; portanto, era um componente de comprimento de baixo ponto de fusão composição ligas, em que compensados pela contracção dos outros componentes de liga, para formar quase isostático bismuto de chumbo ligas eutéticos.
Embora praticamente invisível na natureza, bismuto de alta pureza pode formar distintivo, colorido cristais Hopper. Ele é relativamente não tóxica e tem um baixo ponto de fusão acima 271 ° C, de modo que os cristais podem ser cultivadas utilizando um fogão doméstico, embora os cristais resultantes tendem a ser mais baixas do que os cristais de qualidade cultivadas em laboratório.
Em condições ambientes de bismuto cristaliza no estrutura romboédrica ( Pearson símbolo HR6, grupo espacial R3 m n ° 166), que é muitas vezes classificados em sistemas de cristal trigonal ou hexagonal. Quando comprimido, à temperatura ambiente, esta estrutura bi-I muda primeiro para o monoclínico Bi-II a 2,55 GPa, em seguida, para o tetragonal Bi-III de 2,7 GPa, e, finalmente, para o corpo centrado cúbico Bi-IV em 7,7 GPa. As transições correspondentes podem ser monitorizadas através de alterações na condutividade eléctrica; eles são bastante reprodutíveis e abrupta, e, portanto, são usados para a calibração de equipamento de alta pressão.
Características químicas
O bismuto é estável tanto para o ar seco e húmido a temperaturas normais. Quando em brasa, ele reage com água para fazer (III) óxido de bismuto.
- 2 Bi + 3 H2O → Bi 2 O 3 + 3H 2
Ele reage com flúor para fazer bismuto (V) de fluoreto a 500 ° C ou de bismuto (III) de fluoreto a temperaturas mais baixas (tipicamente de Bi derrete); com outros halogênios ele produz única bismuto halogenetos (III). Os trihaletos são corrosivos e facilmente reagir com a humidade, formando oxi-halogenetos com a fórmula Biox.
- 2 Bi + 3 X 2 → BIX 2 3 (X = F, Cl, Br, I)
Bismuto concentrado dissolve-se em ácido sulfúrico para fazer de bismuto (III) e sulfato dióxido de enxofre.
- 6 H 2 SO 4 + 2 Bi → 6 H2O + Bi 2 (SO 4) 3 + 3 SO 2
Ele reage com ácido nítrico para fazer bismuto (III) de nitrato.
- Bi 6 + HNO 3 → 3 H 2 O + 3 NO 2 + Bi (NO3) 3
Também se dissolve em ácido clorídrico , mas apenas com o oxigénio presente.
- 4 Bi + 3 O 2 + 12 HCl → 4 BiCl 3 + 6 H2O
É usado como um agente transmetalating na síntese de complexos de metais alcalino-terrosos:
- Ba + BiPh 3 → Baph 3 + Bi
Isótopos
A única primordial isótopo de bismuto, bismuto-209, foi tradicionalmente considerado como o mais pesado isótopo estável, mas muito tempo tinha sido suspeito de ser instável em termos teóricos. Este foi finalmente demonstrado em 2003, quando pesquisadores do Instituto de Astrofísica em Spatiale Orsay, França , medido a alfa emissão de semi-vida de 209 Bi para ser 1,9 × 10 19 anos, durante um bilhão de vezes mais do que a atual estimativa idade do universo . Devido à sua extraordinariamente longa meia-vida, para todas as aplicações médicas e industriais presentemente conhecidos, o bismuto pode ser tratada como se fosse estável e não radioativo. A radioactividade é de interesse académico porque o bismuto é um dos poucos elementos cuja radioactividade foi suspeitado e teoricamente previsto, antes de ser detectado no laboratório. Bismuto tem a sua meia-vida mais longa decaimento alfa conhecida, embora telúrio-128 tem uma meia-vida de decaimento beta duplo de mais de 2,2 × 10 24 anos.
Vários isótopos de bismuto com meias-vidas curtas ocorrer dentro das cadeias de desintegração radioactivos de actínio , rádio , e de tório , e mais foram sintetizados experimentalmente. Bismuto-213 também é encontrado na cadeia de decaimento de urânio-233.
Comercialmente, o isótopo radioactivo de bismuto-213 pode ser produzido por bombardeamento rádio com fótons bremsstrahlung a partir de um linac. Em 1997, um anticorpo conjugado com bismuto-213, que tem uma meia-vida de 45 minutos e decai com a emissão de uma partícula alfa, foi utilizado para tratar pacientes com leucemia. Este isótopo tem também sido tentado no tratamento do cancro, por exemplo, no programa de terapia alfa orientada (TAT).
Os compostos químicos
Compostos formas trivalentes e pentavalentes bismuto, os trivalentes sendo mais comum. Muitas das suas propriedades químicas são semelhantes aos de arsénio e antimónio , apesar de serem menos tóxicos do que os derivados de tais elementos mais leves.
Óxidos e sulfuretos
A temperaturas elevadas, os vapores do metal combinam rapidamente com oxigénio, formando o trióxido de amarelo, Bi 2 O 3. Quando fundida, a temperaturas acima de 710 ° C, este óxido corrói qualquer óxido de metal, e até mesmo de platina. Por reacção com a base, forma-se duas séries de oxiânions: Bio -
2, que é polimérica e forma cadeias lineares, e Bio 3-
3. O ânion em Li 3 BiO 3 é na verdade um ânion octam�ica cúbico, Bi 8 O 24
24, enquanto que o anião em Na 3 BiO 3 é tetramérica.
O óxido de bismuto vermelho escuro (V), Bi 2 O 5, é instável, liberando O2 gás após aquecimento.
Sulfeto de bismuto, Bi 2 S 3, ocorre naturalmente em minérios de bismuto. Também é produzido pela combinação de bismuto e de enxofre fundido.
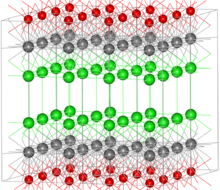
O oxicloreto de bismuto (BiOCl, ver figura à direita) e oxynitate bismuto (BiONO 3) estequiometricamente aparecem como sais aniónicos simples do bismuthyl (III) catião (Bio +), que normalmente ocorre em compostos de bismuto aquosas. No entanto, no caso de BiOCl, as formas de cristal de sal em uma estrutura de placas alternadas de Bi, O, e átomos de Cl, com cada um deles oxigénio em coordenação com quatro átomos de bismuto no plano adjacente. Este composto mineral é usado como um pigmento e cosmética (ver abaixo).
Bismuthine e bismuthides
Ao contrário dos membros anteriores do grupo 15 elementos como nitrogênio, fósforo e arsênico, e semelhante ao anterior grupo de 15 elemento antimónio , bismuto não formar uma estável hidreto de. Hidreto de bismuto, bismuthine (BIH 3), é uma endotérmico composto que se decompõe espontaneamente à temperatura ambiente. Ela só é estável abaixo de -60 ° C. Bismuthides são compostos intermetálicos entre bismuto e outros metais.
Halides
O halogenetos de bismuto em baixos estados de oxidação têm sido mostrados para adoptar estruturas invulgares. O que foi originalmente pensado para ser bismuto (I), cloreto de BiCl, acaba por ser um composto complexo composto por Bi 5+
9 cátions e BiCl 2-
5 e Bi
2 Cl 2-
8 ânions. O Bi 5+
9 tem um catião tricapped distorcida trigonal geometria molecular prismática, e é também encontrada no Bi 10 Hf 3 Cl 18, que é preparado por redução de uma mistura de háfnio (IV) e cloreto de cloreto de bismuto com bismuto elementar, que tem a estrutura [Bi +] [Bi 5+
9] [2- HFCL
6] 3. Outros catiões de bismuto poliatómicos são também conhecidos, tal como Bi 2+
8, encontrada em Bi 8 (AlCl 4) 2. Bismuto também forma um brometo de baixa valência, com a mesma estrutura como "BiCl". Há uma verdadeira monoiodide, BII, que contém cadeias de Bi 4 I 4 unidades. Bii se decompõe com o aquecimento para o triiodeto, BII 3, e bismuto elementar. Também existe um monobrometo da mesma estrutura. Em estado de oxidação +3, formas tri-halogenetos de bismuto com todos os halogéneos: Bif 3, BiCl 3, BIBR 3, e bii 3. Todos estes, exceto BIF 3 são hidrolisado pela água para formar o cátion bismuthyl, Bio +
, O oxycation bismuto comumente encontrado (III) acima referido.
Bismuto (III) reage com cloreto de cloreto de hidrogénio em éter solução para produzir o ácido 4 HBiCl.
O estado de oxidação +5 é menos freqüentemente encontrado. Um tal composto é BIF 5, um oxidante poderoso e agente de fluoração. É também um forte aceitador de flúor, reagindo com tetrafluoride xenon para formar o XEF +
3 cação:
- BIF 5 + XEF 4 → XEF +
3 - Bif
6
Espécies aquosas
Em solução aquosa, a Bi 3+
ião existir em vários estados de hidratação, dependendo do pH:
faixa de pH Espécies <3 Bi (H2O) 3+
60-4 Bi (H2O) 5 OH 2+ 1-5 Bi (H2O) 4 (OH) +
25-14 Bi (H 2 O) 3 (OH) 3 > 11 Bi (H2O) 2 (OH) -
4
Estas espécies mononucleares estão em equilíbrio. Espécies polinucleares também existir, o mais importante dos quais é bio +
, Que existe em forma hexamérica como o complexo octaédrico [Bi 6 O 4 (OH) 4] 6+
(Ou 6 [+ BiO
] 2 · H2O).
Ocorrência e produção
Na crosta da Terra, bismuto é de cerca de duas vezes mais abundante como o ouro. O mais importante minérios de bismuto são bismutinite e bismite. Bismuto nativo é conhecido da Austrália, Bolívia e China.
De acordo com United States Geological Survey, a produção mundial de mineração de bismuto em 2010 foi de 8.900 toneladas, com as maiores contribuições da China (6.500 toneladas), Peru (1.100 toneladas) e do México (850 toneladas). A produção da refinaria foi de 16.000 toneladas, das quais a China produziu 13.000, México e Bélgica 850 800 toneladas.
A diferença entre o mundo bismuto mina e refinaria de produção reflete o status de bismuto como subproduto da extração de outros metais, como chumbo, cobre, estanho, molibdênio e tungstênio. Bismuto viaja em bruto lingote de chumbo (que pode conter até 10% de bismuto) através de várias fases de refinação, até que seja removida pela Processo Kroll-Betterton que separa as impurezas como escória, ou o eletrolítico Processo Betts. Bismuto irá se comportar de forma semelhante com outro de sua principais metais, cobre.
O bismuto metal bruto de ambos os processos ainda contém quantidades consideráveis de outros metais, de chumbo acima de tudo. Ao fazer reagir a mistura fundida com cloro gasoso os metais são convertidos nos seus cloretos de bismuto, enquanto mantém-se inalterado. As impurezas também podem ser removidas por vários outros métodos, por exemplo, com fluxos e tratamentos produzindo alta pureza bismuto metálico (mais de 99% Bi). Mundial bismuto produção das refinarias é uma estatística mais completa e confiável.
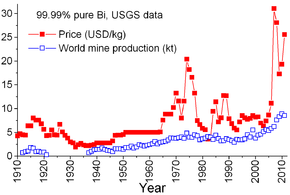
Preço
O preço de bismuto puro metal tem sido relativamente estável durante a maior parte do século 20, com exceção de um pico na década de 1970. Bismuth sempre foi produzido principalmente como subproduto do refino de chumbo, e, portanto, o preço, geralmente refletia o custo da recuperação e do equilíbrio entre a produção ea demanda.
A demanda por bismuto era pequeno antes da Segunda Guerra Mundial e foi farmacêutica - compostos de bismuto foram usados para tratar condições como distúrbios digestivos, doenças e queimaduras sexualmente transmissível. Pequenas quantidades de metais bismuto foram consumidos em ligas fusíveis para sistemas de extintores de incêndio e fio do fusível. Durante a Segunda Guerra Mundial bismuto foi considerado um material estratégico, usado para soldas, ligas fusíveis, medicamentos e pesquisa atômica. Para estabilizar o mercado, os produtores fixaram o preço em US $ 1,25 por libra (2,75 $ / kg) durante a guerra e em US $ 2,25 por libra (4,96 $ / kg) de 1950 até 1964.
No início de 1970, o preço cresceu rapidamente devido ao aumento da procura de bismuto como aditivo metalúrgica de alumínio, ferro e aço. Isto foi seguido por um declínio devido ao aumento da produção mundial, o consumo estabilizado, e as recessões de 1980 e 1981-1982. Em 1984, o preço começou a subir como o consumo aumentou em todo o mundo, especialmente nos Estados Unidos e no Japão. No início de 1990, a investigação começou na avaliação de bismuto como um substituto não tóxico para o chumbo em esmaltes cerâmicos, chumbadas de pesca, equipamentos de processamento de alimentos, livre de usinagem latões para aplicações de canalização, graxas lubrificantes, e disparou para caça às aves aquáticas. O crescimento nestas áreas permaneceu lento durante o meio da década de 1990, apesar de o apoio de substituição do chumbo pelo Governo dos EUA, mas intensificou-se por volta de 2005. Isto resultou em um aumento rápido e contínuo no preço.
Reciclagem
Considerando bismuto é mais disponível hoje como um subproduto, a sua sustentabilidade é mais dependente de reciclagem. O bismuto é em grande parte um subproduto de redução de chumbo, juntamente com prata, zinco , antimónio , e outros metais, e também de tungsténio de produção, juntamente com molibdénio e estanho , e também da produção de cobre. Reciclagem de bismuto é difícil em muitas de suas utilizações finais, principalmente por causa da dispersão.
Provavelmente, o mais fácil de reciclar seria bismuto contendo ligas fusíveis sob a forma de objectos de maior dimensão, em seguida, soldadas objectos maiores. Metade do consumo de solda do mundo está em eletrônica (ou seja, placas de circuito). Tal como os objectos soldados ficam menores ou contêm pouca ou pouco solda de bismuto, a recuperação se torna progressivamente mais difícil e menos económica, embora solda com um teor de prata maior será mais vantajoso recuperar. Próximo na reciclagem de viabilidade seria catalisadores consideráveis com um teor de bismuto justo, talvez como bismuto phosphomolybdate, e, em seguida, bismuto usado na galvanização e como aditivo metalúrgico livre de usinagem.
Bismuto em utilizações em que é dispersa incluem medicamentos mais amplamente estômago ( subsalicilato de bismuto), tintas ( bismuto vanadato) sobre uma superfície seca, cosméticos (perolizados oxicloreto de bismuto), e contendo bismuto balas que foram disparadas. O bismuto espalhadas nesses usos é irrecuperável com a tecnologia atual.
O fato mais importante sobre a sustentabilidade de bismuto é o seu estatuto subproduto, que pode melhorar a sustentabilidade (ou seja, vanádio ou nódulos de manganês) ou, para bismuto de minério de chumbo, restringem-lo; bismuto é restringida. Na medida em que a restrição em bismuto podem ser melhorados ou não vai ser testada pelo futuro da bateria de armazenamento de chumbo, uma vez que 90% do mercado mundial de chumbo é em baterias de armazenamento de gasolina ou veículos a motor movidos a diesel.
A avaliação do ciclo de vida do bismuto incidirá sobre soldas, um dos principais usos do bismuto, e aquele com as informações mais completas. O consumo de energia primária média para soldas é de cerca de 200 MJ por kg, com a solda de alta bismuto (Bi 58%), apenas 20% desse valor, e três soldas de baixa-bismuto (2% a 5% Bi) rodando muito perto a média. O aquecimento global potencial média de 10 a 14 kg de dióxido de carbono , com a solda de alta bismuto cerca de dois terços do que e as soldas de baixa-média cerca de bismuto. O potencial de acidificação para as soldas é cerca de 0,9 to 1,1 kg dióxido de enxofre equivalente, com a solda de alta bismuto e um baixo-bismuto solda apenas um décimo da média e os outros soldados de baixa bismuto cerca de média. Há muito pouca informação do ciclo de vida em outras ligas de bismuto ou compostos.
Aplicações
Bismuto tem poucas aplicações comerciais, nenhum dos quais é particularmente grande. Tomando os EUA como um exemplo, 884 toneladas de bismuto foram consumidos em 2010, dos quais 63% foram em produtos químicos (incluindo farmacêuticos, pigmentos e cosméticos), de 26% em aditivos metalúrgicos para fundição e galvanização, 7% em ligas de bismuto, soldas e munições, bem como o equilíbrio na investigação e outros usos.
Alguns fabricantes usam Bismuth como um substituto em equipamentos para sistemas de água potável, tais como válvulas para atender mandatos "isentos de chumbo" em os EUA (começa em 2014). Este é um aplicativo muito grande uma vez que abrange toda a construção de prédios residenciais e comerciais.
No início de 1990, os pesquisadores começaram a avaliar bismuto como um substituto não tóxico para o chumbo em várias aplicações.
Medicina
O bismuto é um ingrediente em alguns produtos farmacêuticos, embora a utilização de algumas destas substâncias está a diminuir.
- Subsalicilato de bismuto é usado como um antidiarreico ; é o ingrediente ativo em tais preparações "Rosa", como o bismuto Pepto-Bismol, bem como a reformulação de 2004 Kaopectate. É também usado para o tratamento de algumas outras doenças gastro-intestinais. O mecanismo de acção desta substância é ainda não bem documentada, embora um efeito oligodinâmico (efeito tóxico de doses pequenas de iões de metais pesados em micróbios) pode ser envolvido em pelo menos alguns casos. O ácido salicílico a partir da hidrólise do composto antimicrobiano é para toxogenic E. coli, um agente patogénico importante em diarréia do viajante.
- uma combinação de subsalicilato de bismuto e subcitrato de bismuto são usados para tratar úlceras pépticas.
- Bibrocathol é um composto que contém bismuto orgânico utilizado para tratar infecções oculares.
- Subgalato de bismuto, o ingrediente activo em Devrom, é utilizada como um desodorizante interno para tratar o mau odor de flatulência ("gás") e fezes.
- Compostos de bismuto (incluindo bismuto sódio tartarato) foram anteriormente utilizados para tratar a sífilis
- "Leite de bismuto" (uma solução aquosa de hidróxido de bismuto e subcarbonato de bismuto) foi comercializado como um cureall ailimentary no início do século 20
- Subnitrato de bismuto (Bi 5 O (OH) 9 (NO3) 4) e subcarbonato de bismuto (Bi 2 O 2 (CO 3)), também são utilizados em medicina.
Cosméticos e pigmentos
Oxicloreto de bismuto (BiOCl) às vezes é usado em cosméticos, como um pigmento na tinta para sombras de olhos, sprays de cabelo e esmaltes. Este composto é encontrado como o bismoclite mineral e na forma de cristal contém camadas de átomos (ver figura acima) que refractam a luz cromaticamente, resultando numa iridescente aparência semelhante à nácar da pérola. Foi usado como cosmético no antigo Egito e em muitos lugares desde então. Bismuto branco (também "Espanhola branco") pode se referir tanto oxicloreto de bismuto ou oxynitrate bismuto (BiONO 3), quando usado como um pigmento branco.
Metais e ligas
Substituição do chumbo
A diferença de densidade entre chumbo (densidade de 11,32 g · cm -3) e bismuto (densidade 9.78 g · cm -3) é pequeno o suficiente para que para muitos balística e aplicações de ponderação, de bismuto pode substituir o chumbo. Por exemplo, pode substituir o chumbo como um material denso em platinas de pesca. Tem sido utilizado como um substituto para o chumbo em tiro, balas e menos letal munição arma motim. A Holanda , Dinamarca, Inglaterra, País de Gales, os EUA, e muitos outros países já proíbem o uso do chumbo para a caça de aves de zonas húmidas, como muitos pássaros são propensas a envenenamento por chumbo devido à ingestão equivocada de chumbo (em vez de pequenas pedras e cascalho) para ajudar na digestão, ou mesmo proibir o uso de chumbo em toda a caça, como na Holanda . Bismuto e estanho liga de tiro é uma alternativa que proporciona um desempenho balístico semelhante ao chumbo. (Outra alternativa menos dispendiosa mas também mais baixo desempenho é shot "de aço", que é, na verdade, de ferro macio.) Da falta de bismuto maleabilidade, no entanto, torná-lo impróprio para uso na expansão da caça balas.
Bismuto, como um elemento densa de alto peso atômico, é usado em protetores de látex de bismuto-impregnados para proteger de raios-X em exames médicos, tais como TCs, principalmente, pois é considerada não-tóxicas.
A União Europeia 's Restrição de Substâncias Perigosas (RoHS) para a redução do chumbo ampliou o uso de bismuto em eletrônica como um componente de soldas ponto baixo ponto de fusão, como um substituto para soldas de estanho-chumbo tradicionais. A sua baixa toxicidade será especialmente importante para soldas para ser usado em equipamento de processamento de alimentos e de água tubos de cobre, embora também possa ser usado em outras aplicações incluindo as da indústria automóvel, no UE, por exemplo.
Bismuto tem sido avaliada como um substituto para o chumbo livre na maquinagem latões para aplicações de canalização, apesar de não ser igual ao desempenho de aços com chumbo.
Outros usos de metais e ligas especiais
Muitos bismuto ligas têm baixos pontos de fusão e são encontrados em aplicações especializadas, como soldas. Muitos sprinklers automáticos, fusíveis elétricos, e dispositivos de segurança em sistemas de detecção e supressão de incêndio conter a liga eutética In19.1-Cd5.3-Pb22.6-Sn8.3-Bi44.7 que funde a 47 ° C (117 ° F) Esta é uma temperatura conveniente, uma vez que improvável a superação das condições de vida normais. Ligas de baixo ponto de fusão, como o Bi-Cd-Pb-Sn liga que funde a 70 ° C, também são usados na indústria automotiva e de aviação. Antes de deformar uma peça de metal de parede fina, que é preenchido com uma massa fundida ou coberto com uma fina camada da liga para reduzir a possibilidade de ruptura. Em seguida, a liga é removido através da submersão do papel em água a ferver.
O bismuto é usado para fazer livre de usinagem de aços e ligas de alumínio livre de usinagem para propriedades de usinagem de precisão. Ele tem efeito semelhante ao chumbo e melhora a quebra de cavacos durante a usinagem. O encolhimento aquando da solidificação do chumbo e a expansão de bismuto compensa uns aos outros e, por conseguinte, chumbo e bismuto são muitas vezes utilizados em quantidades similares. Do mesmo modo, as ligas contendo partes comparáveis de bismuto e exibem uma mudança muito pequena (da ordem de 0,01%) durante a fusão, solidificação ou envelhecimento. Essas ligas são utilizadas na fundição de alta precisão, por exemplo, em odontologia, para criar modelos e moldes. Bismuto também é usado como um agente de liga na produção de ferros maleáveis e como um material de termopar.
Algumas ligas de bismuto, tais como Bi35-Pb37-Sn25, são combinados com materiais não-aderentes, tais como mica, vidro e esmaltes porque eles facilmente os molhe permitindo fazer articulações com outras partes. A adição de bismuto para césio melhora o rendimento quântico de catodos Cs. Sinterização de bismuto e de manganês em pó em 300 ° C produz um ímã permanente e material magnetostritivo, que é usado em geradores de ultra-sons e receptores que trabalham na gama de 10-100 kHz e em dispositivos de memória magnéticos.
Outras utilizações como compostos
- O bismuto é incluído em BSCCO (bismuto estrôncio cálcio óxido de cobre), que é um grupo de compostos supercondutores semelhantes descobertos em 1988, que apresentam as mais elevadas temperaturas de transição supercondutora.
- Subnitrato de bismuto é um componente de esmaltes que produz um iridescence e é usado como um pigmento na tinta.
- Telureto de bismuto é um semicondutor e um excelente material termoelétrico. Bi 2 te 3 diodos são utilizados em refrigeradores móveis, CPU refrigeradores, e como detectores em espectrofotômetros infravermelhos.
- Óxido de bismuto, na sua forma de delta, é um electrólito sólido para o oxigénio. Esta forma normalmente apenas existe acima e reparte-se abaixo de um limiar de alta temperatura, mas podem ser electrodepositadas bem abaixo desta temperatura numa solução altamente alcalina.
- Vanadato de bismuto é um pigmento amarelo opaco em óleo dos artistas e tinta acrílica. Este composto é um substituto resistentes à luz não-tóxico para limão pigmentos amarelos, tais como os sulfuretos de cádmio e o chumbo / estrôncio / bário cromados. Ao contrário de cromato de chumbo + chumbo sulfato de limão, vanadato de bismuto não facilmente escurecer com a exposição UV.
- Um catalisador para a fabricação de fibras acrílicas.
- Ingrediente em lubrificante graxas.
- Em microstars crepitação ( ovos de dragão) em pirotecnia, como o óxido, subcarbonato ou subnitrato.
Toxicologia e ecotoxicologia
A literatura científica concorda que o bismuto ea maioria dos seus compostos são menos tóxicos em comparação com outros metais pesados (chumbo, antimônio, etc.) e que não é bioacumulativo. Eles têm baixa solubilidade no sangue, são facilmente removidos com a urina, e não mostrou nenhum cancerígenas, mutagénicas ou efeitos teratogênicos em testes de longa duração em animais (até 2 anos). A sua semi-vida biológica para a retenção de corpo inteiro é de 5 dias, mas pode permanecer no rim por ano em pacientes tratados com compostos de bismuto.
Envenenamento bismuto existe e afecta principalmente o rim, fígado, bexiga e. Pele e irritação das vias respiratórias pode também acompanhar a exposição aos respectivos órgãos. Tal como acontece com chumbo, a exposição excessiva ao bismuto pode resultar na formação de um depósito sobre o negro gengiva, conhecida como uma linha de bismuto.
Impactos ambientais de bismuto que não são muito bem conhecidos. Considera-se que o seu impacto ambiental é pequeno, devido, em parte, à baixa solubilidade dos seus compostos. A informação limitada no entanto significa que um olhar atento deve ser mantido sobre o seu impacto.