
Cobalto
Informações de fundo
Esta seleção Wikipedia está offline disponível a partir de Crianças SOS, para distribuição no mundo em desenvolvimento. Patrocínio da criança ajuda as crianças uma a uma http://www.sponsor-a-child.org.uk/ .
| Cobalto | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
27 Co | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||||||||||
metal duro cinza brilhante  | |||||||||||||||||||||||||||||||||||||
| Propriedades gerais | |||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | cobalto, Co, 27 | ||||||||||||||||||||||||||||||||||||
| Pronúncia | / k oʊ b ɒ l t / KOH -Parafuso | ||||||||||||||||||||||||||||||||||||
| Categoria elemento | de metal de transição | ||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | 9, 4, d | ||||||||||||||||||||||||||||||||||||
| Peso atômico padrão | 58.933195 (5) | ||||||||||||||||||||||||||||||||||||
| Configuração eletrônica | [ Ar ] 4s 3d 2 7 2, 8, 15, 2 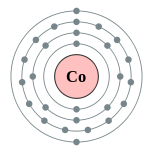 | ||||||||||||||||||||||||||||||||||||
| História | |||||||||||||||||||||||||||||||||||||
| Descoberta | Georg Brandt (1732) | ||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||
| Cor | cinza metálico | ||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||
| Densidade (perto RT) | 8,90 g cm -3 · | ||||||||||||||||||||||||||||||||||||
| Líquido densidade no pf | 7,75 g cm -3 · | ||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 1768 K , 1495 ° C, 2723 ° F | ||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 3200 K, 2927 ° C, 5301 ° F | ||||||||||||||||||||||||||||||||||||
| Calor de fusão | 16.06 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||
| Calor de vaporização | 377 kJ mol -1 · | ||||||||||||||||||||||||||||||||||||
| Capacidade calorífica molar | 24,81 J · · mol -1 K -1 | ||||||||||||||||||||||||||||||||||||
| Pressão de vapor | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Propriedades atômicas | |||||||||||||||||||||||||||||||||||||
| Estados de oxidação | 5, 4, 3, 2, 1, -1 ( óxido anfotérico) | ||||||||||||||||||||||||||||||||||||
| Eletronegatividade | 1,88 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||
| Energias de ionização ( Mais) | 1º: 760,4 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| 2: 1648 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||
| 3: 3232 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||
| Raio atômico | 125 pm | ||||||||||||||||||||||||||||||||||||
| O raio de covalência | 126 ± 3 (baixa rotação), 150 ± 7 (alta rotação) pm | ||||||||||||||||||||||||||||||||||||
| Miscelânea | |||||||||||||||||||||||||||||||||||||
| A estrutura de cristal | hexagonal repleto de perto | ||||||||||||||||||||||||||||||||||||
| Ordenamento magnético | ferromagnético | ||||||||||||||||||||||||||||||||||||
| Resistividade elétrica | (20 ° C) 62,4 Nco · m | ||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 100 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||
| Expansão térmica | (25 ° C) de 13,0 pM · · K -1 m -1 | ||||||||||||||||||||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C) 4720 m · s -1 | ||||||||||||||||||||||||||||||||||||
| O módulo de Young | 209 GPa | ||||||||||||||||||||||||||||||||||||
| Módulo de cisalhamento | 75 GPa | ||||||||||||||||||||||||||||||||||||
| Massa de módulo | 180 GPa | ||||||||||||||||||||||||||||||||||||
| Rácio de Poisson | 0.31 | ||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 5 | ||||||||||||||||||||||||||||||||||||
| Dureza de Vickers | 1.043 MPa | ||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 700 MPa | ||||||||||||||||||||||||||||||||||||
| Número de registo CAS | 7440-48-4 | ||||||||||||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | |||||||||||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de cobalto | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
O cobalto é um elemento químico com o símbolo Co e número atômico 27. É naturalmente encontrado apenas na forma quimicamente combinada. O elemento livre, produzido pela fundição redutora, é um duro, brilhante, cinza-prateado de metal .
Pigmentos azuis-base de cobalto ( azul cobalto) têm sido usadas desde os tempos antigos para jóias e pinturas, e para conferir um distintivo tonalidade azul ao vidro, mas a cor mais tarde foi pensado pelos alquimistas para ser devido ao metal conhecido bismuto . Os mineiros tinham muito utilizado o nome minério kobold (alemão para o minério de goblin) para alguns dos produtores de minerais azul-pigmento; eles foram chamados porque eram pobres em metais conhecidos e deu venenoso arsênico -contendo fumaça em cima de fundição. Em 1735, esses minérios foram encontrados para ser redutível a um novo metal (o primeiro descoberto desde os tempos antigos), e este acabou por ser nomeado para o kobold.
Hoje, alguns cobalto é produzido especificamente a partir de vários minérios metálicos-Abrilhantado, por exemplo cobaltita (CoAsS), mas a fonte principal do elemento é como um subproduto de cobre e níquel de mineração. O cinturão do cobre na República Democrática do Congo e Zâmbia produz a maior parte do metal cobalto extraído em todo o mundo.
O cobalto é utilizado na preparação de magnético , resistente ao desgaste e maior resistência ligas. Silicato de cobalto e cobalto (II) aluminato (carvão 2 O 4, azul cobalto) dar uma profunda cor azul distintivo de vidro , smalt, cerâmicas, tintas, tintas e vernizes. Cobalt ocorre naturalmente como apenas um isótopo estável, cobalto-59. Cobalto-60 é um radioisótopo comercialmente importante, utilizada como um traçador radioactivo e na produção de raios gama.
Cobalt é o centro ativo de coenzymes chamado cobalamins, o exemplo mais comum de que é a vitamina B 12 . Como tal, é um traço essencial minerais na dieta de todos os animais. Cobalto em forma inorgânica é também um nutriente ativo para bactérias, algas e fungos .
Características

O cobalto é um de metal ferromagnético com uma gravidade específica de 8,9. Cobalto puro não se encontra na natureza, mas os compostos de cobalto são comuns. Pequenas quantidades de que são encontrados na maioria das rochas, solo, plantas e animais. O Temperatura de Curie é 1115 ° C e o momento magnético é 1,6-1,7 Magnetons Bohr por átomo . Na natureza, ele é freqüentemente associada com o níquel, e ambos são componentes secundários característicos ferro meteórico. O cobalto tem um permeabilidade relativa que dois terços de ferro . Metallic cobalto ocorre como dois estruturas cristalográficas: hcp e FCC. A temperatura de transição ideal entre a HCP e estruturas FCC é de 450 ° C, mas, na prática, a diferença de energia é tão pequena que intercrescimento aleatória dos dois é comum.
O cobalto é um metal redutor fracamente que é protegido da oxidação por uma película de óxido de passivação. Ele é atacado por halogênios e enxofre. Aquecimento em oxigênio produz Co 3 O 4 que perde oxigénio a 900 ° C para se obter o monóxido de CoO. O metal reage com F 2 a 520 K para se obter CoF 3, com Cl2, Br2 e 2, os halogenetos binários correspondentes foram formados. Não tem qualquer reacção com H 2 e N 2 , mesmo quando aquecido, mas reage com o boro , carbono , fósforo , arsénio e enxofre . A temperaturas normais, que reage lentamente com ácidos minerais, e muito lentamente com húmido, mas não seco, ar.
Compostos
Comuns estados de oxidação de cobalto incluem 2 e 3, embora compostos com estados de oxidação que variam de -3 a 4 também são conhecidos. Um estado de oxidação comum para compostos simples é 2. O cobalto (II), sais de formar o vermelho-rosa [Co (H2O) 6] 2+ complexo em solução aquosa. A adição de cloreto dá a intensamente azul [CoCl
4] 2-
.
Compostos oxigenados e Calcogênio
Vários óxidos de cobalto são conhecidos. Verde de óxido de cobalto (II) (COO) possui estrutura de sal gema. É facilmente oxidado com água e oxigénio para cobalto (III) de hidróxido de castanho (Co (OH) 3). A temperaturas de 600-700 ° C, COO oxida para o azul cobalto (II, III), óxido de (Co 3 O 4), que tem um estrutura espinélio. Preto cobalto (III), óxido de (Co 2 O 3) também é conhecido. Óxidos de cobalto são antiferromagnetic a baixa temperatura : COO ( Temperatura Neel 291 K) e Co 3 O 4 (temperatura Neel: 40 K), que é análoga à magnetita (Fe 3 O 4), com uma mistura de 2 e 3 estados de oxidação.
O diretor da escola calcogenetos de cobalto incluem o negro cobalto (II) sulfetos, COS 2, que adota uma pirita estrutura -como, e Co 2 S 3. Pentlandite (Co 9 S 8) é rica em metal.
Halides

Quatro di-halogenetos de cobalto (II) são conhecidos: cobalto fluoreto (II) (CoF 2, rosa), cloreto de cobalto (II) (CoCl2, azul), cobalto brometo de (II) (COBR 2, verde), cobalto (II) iodeto (COI 2, azul-preto). Estes halogenetos de existir em formas anidras e hidratadas. Considerando que o dicloreto anidro é azul, o hidrato é vermelho.
O potencial de redução para a reacção
- Co 3+
+ E - → Co 2+
é 1,92 V, para além de que, para cloro de cloreto, 1,36 V. Como uma consequência de cobalto (III) e cloreto de resultaria no cobalto (III) a ser reduzido para cobalto (II). Uma vez que o potencial de redução de flúor ao fluoreto é tão alta, 2,87 V, de cobalto (III) de fluoreto é um dos poucos compostos simples estável cobalto (III). O cobalto (III) de fluoreto, que é usado em algumas reacções de fluoração, reage vigorosamente com água.
Compostos de coordenação
Como para todos os metais, compostos moleculares de cobalto são classificados como complexos de coordenação, isto é, moléculas ou iões que contêm cobalto ligada a várias ligandos. Os princípios de eletronegatividade e dureza-suavidade de uma série de ligandos podem ser usadas para explicar o estado de oxidação habitual do cobalto. Por exemplo Co três complexos tendem a ter ligantes ammine. Como o fósforo é mais suave do que o nitrogênio, ligantes de fosfina tendem a apresentar o mais suave Co 2+ e Co +, sendo um exemplo o tris (trifenilfosfina) de cobalto (I), cloreto de ((P (C 6 H 5) 3) 3 CoCl). O óxido de flúor e mais electronegativo (e mais) podem estabilizar e Co Co 4+ 5+ derivados, por exemplo hexafluorocobaltate césio (Cs 2 CoF 6) e percobaltate potássio (K 3 CoO 4).
Alfred Werner, um ganhador do prêmio Nobel pioneira em química de coordenação, trabalhou com compostos de fórmula empírica CoCl 3 (NH 3) 6. Um dos isómeros foi determinada cobalto (III), cloreto de hexammine. Este complexo de coordenação, um "típico" complexo de Werner-tipo, consiste em um átomo de cobalto centro coordenado por seis ligandos ammine ortogonais umas às outras e três contra-aniões de cloreto. Usando quelante ligantes etilenodiamina no lugar de amoníaco dá tris (etilenodiamina) cobalto (III), cloreto de ([Co (en) 3] Cl 3), que foi um dos primeiros complexos de coordenação que foi resolvido nos isómeros ópticos. O complexo existe como ambas as formas, quer de direita ou canhotos de uma "hélice de três pás". Este complexo foi isolado pela primeira vez por Werner como cristais em forma de agulha amarelo-ouro.
Os compostos organometálicos
Cobaltocene é um análogo estrutural ferroceno, onde cobalto substitui ferro. Cobaltocene é sensível à oxidação, muito mais do que o ferroceno. Carbonilo de cobalto (Co 2 (CO 8)) é um catalisador em reacções de carbonilação. A vitamina B 12 (ver abaixo ) é um composto organometálico encontrado na natureza e é a única vitamina que contêm um átomo de metal.
Isótopos
59 Co é a única cobalto estável isótopo e o único isótopo de existir na natureza. 22 radioisótopos foram caracterizados com os mais estáveis Co 60 com uma meia-vida de 5,2714 anos, 57 Co, com uma semi-vida de 271,79 dias, 56 Co, com uma semi-vida de 77,27 dias, e 58 Co com uma meia-vida de 70,86 dias. Todos os restantes Os isótopos radioactivos têm semi-vidas mais curtas do que 18 horas, e a maior parte delas são mais curtos do que 1 segundo. Este elemento apresenta também 4 meta estados, todos com meias-vidas mais curtas do que 15 minutos.
Os isótopos de gama cobalto em peso atômico de 50 u (50 Co) de 73 u (73 Co). O primário modo de decaimento para isótopos com unidade de massa atómica valores menores do que o do isótopo estável mais abundante, 59 Co, é captura eletrônica eo primeiro modo de decaimento para aqueles de maior do que 59 unidades de massa atómica é decaimento beta. O primário produtos de decaimento antes de 59 Co são elemento 26 ( de ferro ) isótopos e os primeiros produtos após são os elementos 28 (níquel) isótopos.
História

Os compostos de cobalto têm sido usadas durante séculos para transmitir uma rica cor azul para vidro , esmaltes e cerâmica. Cobalt tem sido detectado em escultura egípcia e jóias Pérsico a partir do terceiro milênio aC, nas ruínas de Pompéia (destruída em 79 dC), e na China datam da dinastia Tang (618-907 AD) e da dinastia Ming (1368-1644 AD).
Cobalt tem sido usado para colorir vidro desde a Idade do Bronze . A escavação da Uluburun naufrágio rendeu um lingote de vidro azul, que foi lançado durante o século 14 aC. Artigos de vidro azul do Egito são coloridos com cobre, ferro, ou cobalto. O mais antigo de vidro cor de cobalto foi a partir do momento da Dinastia XVIII em Egipto (1550-1292 aC). A localização, onde foram obtidos os compostos de cobalto é desconhecido.
A palavra de cobalto é derivado do kobalt alemão, a partir kobold significado "goblin", um termo usado para o supersticioso minério de cobalto por mineiros. As primeiras tentativas de fundição para a produção de estes minérios de metais tais como o cobre ou níquel falharam, obtendo-se simplesmente em pó (de cobalto (II), óxido) em vez disso. Além disso, como os minérios primários de cobalto sempre contêm arsênico, fundição do minério oxidado o teor de arsénio na altamente tóxico e volátil óxido de arsênico, que também diminuiu a reputação do minério para os mineiros.
Químico sueco Georg Brandt (1694-1768) é creditado com a descoberta de cobalto circa 1735, apresentando-se como um novo elemento até então desconhecido diferente de bismuto e outros metais tradicionais, e chamando-o de um novo "semi-metal." Ele foi capaz de mostrar que os compostos de metal de cobalto foram a fonte da cor azul em vidro, que tinha sido previamente atribuído ao bismuto encontrada com cobalto. Cobalt tornou-se o primeiro metal a ser descoberto desde o período pré-histórico, durante o qual todos os metais conhecidos (ferro, cobre, prata, ouro, zinco, mercúrio, estanho, chumbo e bismuto) não tinha descobridores gravados.
Durante o século 19, uma parte significativa da produção mundial de azul cobalto (um corante feito com compostos de cobalto e alumina) e smalt ( vidro de cobalto em pó para uso para fins de pigmento em cerâmica e pintura) foi realizado na Noruega Blaafarveværket. As primeiras minas para a produção de smalt no dia 16 ao século 18 estavam localizados na Noruega, Suécia , Saxónia e Hungria. Com a descoberta de minério de cobalto em Nova Caledônia , em 1864, a mineração de cobalto na Europa diminuiu. Com a descoberta de jazidas de minério em Ontário, Canadá em 1904 e a descoberta de depósitos ainda maiores no Província de Katanga, no Congo , em 1914, as operações de mineração mudou de novo. Com o Shaba conflito a partir de 1978, a principal fonte de cobalto, as minas de cobre da província de Katanga, quase parou sua produção. O impacto sobre a economia mundial de cobalto deste conflito foi, porém, menor que o esperado. Cobalt sendo um raro eo pigmento sendo altamente tóxico, a indústria tinha já estabelecido formas eficazes para reciclagem de materiais de cobalto e em alguns casos foi capaz de mudar para alternativas livres de cobalto.
Em 1938, John e Livingood Glenn T. Seaborg descobriu cobalto-60. Este isótopo foi famosamente utilizada no Universidade de Columbia na década de 1950 para estabelecer violação de paridade em radioativo decaimento beta.
Após a Segunda Guerra Mundial, os EUA queriam ter certeza de que nunca foi menos do que o minério necessário para cobalto como os alemães estavam e fomos explorar para um fornecimento dentro da fronteira com os EUA. Uma boa oferta de minério necessário foi encontrado em Idaho perto Canyon Blackbird no lado de uma montanha. A empresa Calera Mining Company tem a produção começou no local.
Ocorrência
A forma estável de cobalto é criado em supernovas via processo-r. Compreende 0,0029% da crosta da Terra e é um dos primeiros metal de transição série.
Cobalto ocorre em cobre e níquel sais minerais e em combinação com enxofre e arsênio no sulfidic cobaltita (CoAsS), safflorite (CoAs 2) e skutterudite (CoAs 3) minerais. O mineral cattierite é semelhante a pirite e ocorre em conjunto com vaesite nos depósitos de cobre da Província de Katanga. Ao entrar em contacto com a atmosfera, intemperismo ocorre e os minerais de sulfureto oxidar para formar rosa erythrite ("glance cobalto": Co 3 (ASO 4) 2 · 8H 2 O) e spherocobaltite (CoCo 3).
Cobalto não é encontrado como um de metal nativa, mas é obtido principalmente como um subproduto do níquel e cobre atividades de mineração. Os principais minérios de cobalto são cobaltite, erythrite, glaucodot e skutterudite.
Produção

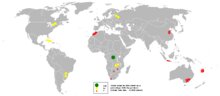
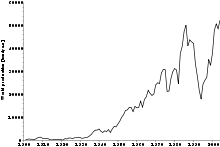
Em 2005, os depósitos de cobre na província de Katanga (Shaba antiga província) da República Democrática do Congo foram o maior produtor de cobalto com quase 40% de participação mundial, relata a British Geological Survey. A situação política no Congo influencia o preço do cobalto significativamente.
O Projeto Mukondo Mountain, operado pelo Central Africano Mining and Exploration Company, em Katanga, pode ser o reserva de cobalto mais rico do mundo. Estima-se para ser capaz de produzir cerca de um terço da produção mundial total de cobalto em 2008. Em julho de 2009 CAMEC anunciou um acordo de longo prazo em que CAMEC iria entregar toda a sua produção anual de concentrado de cobalto em Mukondo Montanha de Zhejiang Galico Cobalt & Materiais de níquel da China.
Existem vários métodos para a separação de cobalto a partir de cobre e de níquel. Eles dependem da concentração de cobalto e a composição exacta do minério usado. Uma fase de separação envolve flutuação de espuma, em que os tensioactivos se ligam a diferentes componentes de minério, conduzindo a um enriquecimento de minérios de cobalto. Subseqüente torrefação converte os minérios para o sulfato de cobalto, enquanto que o cobre e o ferro são oxidados para o óxido. O lixiviação com água extrai o sulfato em conjunto com o arseniatos. Os resíduos são ainda lixiviado com ácido sulfúrico obtendo-se uma solução de sulfato de cobre. Cobalto também pode ser lixiviado a partir da escória da fundição de cobre.
Os produtos dos processos acima mencionados são transformados para o óxido de cobalto (Co 3 O 4). Este óxido é reduzido ao metal pela reacção aluminotérmica ou redução com carbono numa alto-forno.
Aplicações
A principal aplicação é de cobalto como metal de ligas.
Alloys
Base de cobalto- superligas consumir a maior parte do cobalto produzido. A estabilidade térmica destas ligas torna-os adequados para uso em pás de turbinas de gás para turbinas e jet aeronaves motores, embora baseada em níquel ligas de cristal único ultrapassá-los nesse sentido. Ligas à base de cobalto são também corrosão e resistente ao desgaste. Isto torna-os úteis no campo da medicina, onde o cobalto é frequentemente utilizado (ao longo de titânio ) para ortopédica implantes que não se desgastam ao longo do tempo. O desenvolvimento dos ligas de cobalto resistentes ao desgaste começou na primeira década do século 19 com a stellite ligas, que são ligas de cobalto-cromo com variação de tungstênio e teor de carbono. A formação de crómio e carbonetos de tungstênio torna muito duro e resistente ao desgaste. Especiais de cobalto-crómio molibdênio ligas como Vitallium são usados para componentes protéticos, como quadril e joelho. Ligas de cobalto são também utilizados para próteses dentárias, onde eles são úteis para evitar alergias ao níquel. Alguns alta velocidade brocas de aço também usam cobalto para aumentar o calor e resistência ao desgaste. As ligas especiais de alumínio, níquel, cobalto e ferro, como conhecido Alnico, e de samário e cobalto ( samário cobalto ímã) são usados em ímãs permanentes . Também é misturado com 95% de platina para fins de jóias, obtendo-se uma liga que é adequado para a fundição detalhado fino e é também ligeiramente magnética.
Baterias
Óxido de cobalto e lítio (LiCoO2) é amplamente utilizado em lítio catodos de baterias de iões. O material é constituído por camadas de óxido de cobalto em que é o lítio intercalada. Durante descarregar o lítio intercalada entre as camadas é definido como livre de iões de lítio. Níquel-cádmio (NiCd) e níquel metal hidreto (NiMH) baterias também contêm quantidades significativas de cobalto; o cobalto melhora as capacidades de oxidação do níquel na bateria.
Catálise
Vários compostos de cobalto são utilizados em reacções químicas como catalisadores de oxidação. Acetato de cobalto é utilizado para a conversão de xileno para ácido tereftálico, o precursor do polímero a granel tereftalato de polietileno. Os catalisadores típicos são o cobalto carboxilatos (conhecidos como sabonetes cobalto). Eles também são utilizados em tintas, vernizes e tintas, como agentes de secagem, "" através da oxidação de óleos de secagem. Os carboxilatos mesmos são utilizados para melhorar a aderência da borracha a aço em pneus radiais com cinto de aço.
Os catalisadores à base de cobalto são também importantes em reacções envolvendo o monóxido de carbono . Reforma a vapor, útil em produção de hidrogénio, utiliza catalisadores de óxido de cobalto-base. O cobalto é um catalisador igualmente no Processo de Fischer-Tropsch, usado na hidrogenação de monóxido de carbono em combustíveis líquidos. O hidroformilação de alcenos muitas vezes dependem de octacarbonilo de cobalto como o catalisador, apesar de tais processos têm sido parcialmente deslocadas por iridium- catalisadores à base de ródio e mais eficientes, por exemplo, a Processo Cativa.
O hidrodessulfurização de petróleo utiliza um catalisador derivado de cobalto e molibdénio. Este processo ajuda a libertar impurezas de enxofre de petróleo que interferem com a refinação de combustíveis líquidos.
Os pigmentos e corantes


Antes do século 19, o uso predominante de cobalto era como pigmento. Desde a Idade Média, ele esteve envolvido na produção de smalt, um vidro colorido azul. Smalt é produzida por fusão de uma mistura do mineral torrado smaltite, quartzo e carbonato de potássio, obtendo-se um vidro de silicato de azul-escuro, que é moído, após a produção. Smalt foi amplamente utilizado para a coloração de vidro e como pigmento para pinturas. Em 1780, Sven Rinman descoberto cobalto e verde em 1802 Louis Jacques Thénard descoberto azul cobalto. As duas variedades de azul cobalto, cobalto aluminato de cobalto e verde (uma mistura de de óxido de cobalto (II) e óxido de zinco), foram utilizados como pigmentos para pinturas, devido à sua estabilidade superior.
Radioisótopos
Cobalto-60 (Co-60 ou de 60 Co) é útil como uma fonte de raios gama, pois pode ser produzido em quantidade previsível e alto atividade bombardeando cobalto com nêutrons . Ela produz dois raios gama com energias de 1,17 e 1,33 MeV.
Seus usos incluem radioterapia externa, a esterilização de material médico e de resíduos hospitalares, tratamento de radiação de alimentos para esterilização (frio pasteurização), industrial Radiografia (por exemplo, solda radiografias de integridade), medições de densidade (por exemplo, medidas de densidade de concreto) e switches de altura de enchimento do tanque. O metal tem o infeliz hábito de produzir um pó fino, causando problemas de protecção contra as radiações. Cobalto a partir de máquinas de radioterapia tem sido um perigo grave quando não descartados corretamente, e um dos piores acidentes de contaminação de radiação na América do Norte ocorreu em 1984, após uma unidade de radioterapia descartada contendo cobalto-60 foi erroneamente desmontado em um ferro-velho em Juarez, México.
Cobalto-60 tem uma semi-vida radioactiva de 5,27 anos. Esta diminuição da atividade requer substituição periódica das fontes utilizadas em radioterapia e é uma das razões por que as máquinas de cobalto têm sido largamente substituídas por aceleradores lineares em radioterapia moderna.
Cobalto-57 (Co-57 ou 57 Co) é um radioisótopo de cobalto mais frequentemente utilizados em exames médicos, tal como um marcador radioactivo para absorção de vitamina B 12, e para o Schilling teste. Cobalto-57 é utilizada como uma fonte Espectroscopia Mössbauer e é uma das várias fontes possíveis em Dispositivos de fluorescência de raios-X.
Projetos de armas nucleares poderia intencionalmente incorporar 59 Co, alguns dos quais seriam ativados em um explosão nuclear para produzir 60 Co. A 60 Co, disperso como precipitação nuclear, cria o que às vezes é chamado de bomba de cobalto.
Outros usos
Outros usos de cobalto são em galvanoplastia, devido à sua aparência atraente, dureza e resistência às oxidação e, como casacos de terra para porcelana esmaltes.
Papel biológico
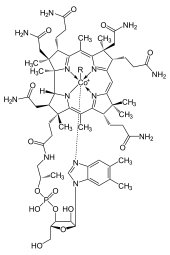
O cobalto é essencial para todos os animais . É um componente essencial da cobalamina, também conhecido como vitamina B 12, que é o reservatório biológico primário de cobalto como um elemento "ultratrace". As bactérias nas vísceras de animais ruminantes converter sais de cobalto em vitamina B 12, um composto que pode somente ser produzida por bactérias ou archaea. A presença mínima de cobalto em solos, por conseguinte, melhora marcadamente a saúde de animais de pasto, e uma absorção de 0,20 mg / kg por dia é recomendado para eles, como eles podem obter vitamina B 12 em nenhuma outra maneira. No início do século 20 durante o desenvolvimento para a agricultura da North Island Plateau vulcânica da Nova Zelândia, o gado sofreu o que foi denominado "doença bush". Descobriu-se que os solos vulcânicos faltava sais de cobalto, que foi necessário para o gado. A doença foi curada por adição de pequenas quantidades de cobalto para fertilizantes.
Na década de 1930 "doença costa" de ovinos na Ninety Mile Deserto do Sudeste de Sul da Austrália foi encontrado para ser devido a deficiência de nutrientes do oligoelementos cobalto e cobre. A deficiência de cobalto foi superado pelo desenvolvimento de cobalto "balas", pellets densas de óxido de cobalto misturado com barro, que são inseridos por via oral a apresentar no rúmen do animal.
Herbívoros não ruminantes produzir vitamina B 12 a partir de bactérias em seus dois pontos que mais uma vez fazer a vitamina a partir de sais de cobalto simples. No entanto, a vitamina não pode ser absorvida a partir do cólon, e assim não ruminantes devem ingerir fezes obter o nutriente. Animais que não seguem estes métodos de obtenção de vitamina B 12 a partir de suas próprias bactérias gastrointestinais ou de outros animais, deve obter a vitamina pré-fabricados em outros produtos de origem animal em sua dieta, e eles não podem se beneficiar da ingestão de sais de cobalto simples.
As proteínas à base de cobalamina usar corrin para segurar o cobalto. Coenzima B 12 possui uma ligação C-Co reactivo, que participa nas suas reacções. Em humanos, existe B 12 com dois tipos de alquilo de ligando: metilo e adenosil. MEB 12 promove metilo (-CH 3) transferências de grupo. A versão B adenosil de 12 catalisa rearranjos no qual um átomo de hidrogénio é directamente transferidos entre dois átomos adjacentes com concomitante troca do segundo substituinte, X, que pode ser um átomo de carbono com substituintes, um átomo de oxigénio de um álcool ou uma amina. Metilmalonil mutase Coenzima A (MUT) Converte MML-CoA para Su-CoA, um passo importante para a extracção de energia a partir de proteínas e gorduras.
Embora muito menos comum do que outras metalloproteins (por exemplo, os de zinco e ferro), cobaltoproteins são conhecidos além de B 12. Estas proteínas incluem metionina aminopeptidase 2 uma enzima que ocorre em seres humanos e outros mamíferos que não utilizam o anel de corrina de B 12, mas liga-se directamente cobalto. Outra enzima de cobalto não é corrina nitrilo hidratase, uma enzima em bactérias que são capazes de metabolizar nitrilos.
Precauções
O cobalto é um elemento essencial para a vida em quantidades diminutas. O 50 índice LD de sais de cobalto solúveis foi estimada entre 150 e 500 mg / kg. Assim, para uma pessoa a 100 kg LD 50 seria de cerca de 20 gramas.
Depois de níquel e crómio, cobalto é uma das principais causas de A dermatite de contato. Em 1966, a adição de compostos de cobalto para estabilizar espuma de cerveja no Canadá levou a cardiomiopatia, que veio a ser conhecida como cardiomiopatia de bebedor de cerveja.
