
Tálio
Você sabia ...
Crianças SOS têm produzido uma seleção de artigos da Wikipédia para escolas desde 2005. Clique aqui para mais informações sobre Crianças SOS.
| Tálio | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
81 Tl | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Aparência | ||||||||||||||||||||||||||||
branco prateado  | ||||||||||||||||||||||||||||
| Propriedades gerais | ||||||||||||||||||||||||||||
| Nome, símbolo, número | tálio, Tl, 81 | |||||||||||||||||||||||||||
| Pronúncia | / θ æ l Eu ə m / THAL -ee-əm | |||||||||||||||||||||||||||
| Categoria elemento | metais de transição pós- | |||||||||||||||||||||||||||
| Grupo, período, bloco | 13, 6, p | |||||||||||||||||||||||||||
| Peso atômico padrão | 204,38 (1) | |||||||||||||||||||||||||||
| Configuração eletrônica | [ Xe ] 4f 14 5d 10 6s 2 6p 1 2, 8, 18, 32, 18, 3 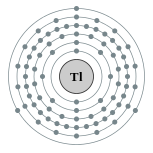 | |||||||||||||||||||||||||||
| História | ||||||||||||||||||||||||||||
| Descoberta | William Crookes (1861) | |||||||||||||||||||||||||||
| Primeiro isolamento | Claude-Auguste Lamy (1862) | |||||||||||||||||||||||||||
| Propriedades físicas | ||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||
| Densidade (perto RT) | 11,85 g · cm -3 | |||||||||||||||||||||||||||
| Líquido densidade no pf | 11,22 g · cm -3 | |||||||||||||||||||||||||||
| Ponto de fusão | 577 K , 304 ° C, 579 ° F | |||||||||||||||||||||||||||
| Ponto de ebulição | 1746 K, 1473 ° C, 2683 ° F | |||||||||||||||||||||||||||
| Calor de fusão | 4.14 kJ mol -1 · | |||||||||||||||||||||||||||
| Calor de vaporização | 165 kJ mol -1 · | |||||||||||||||||||||||||||
| Capacidade calorífica molar | 26,32 J · · mol -1 K -1 | |||||||||||||||||||||||||||
| Pressão de vapor | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Propriedades atômicas | ||||||||||||||||||||||||||||
| Estados de oxidação | 3, 2, 1 (Levemente óxido de base) | |||||||||||||||||||||||||||
| Eletronegatividade | 1,62 (escala de Pauling) | |||||||||||||||||||||||||||
| Energias de ionização | 1º: 589,4 kJ · mol -1 | |||||||||||||||||||||||||||
| 2: 1971 kJ · mol -1 | ||||||||||||||||||||||||||||
| 3: 2878 kJ · mol -1 | ||||||||||||||||||||||||||||
| Raio atômico | 170 pm | |||||||||||||||||||||||||||
| O raio de covalência | 145 ± 19:00 | |||||||||||||||||||||||||||
| Van der Waals raio | 196 pm | |||||||||||||||||||||||||||
| Miscelânea | ||||||||||||||||||||||||||||
| A estrutura de cristal | hexagonal repleto de perto | |||||||||||||||||||||||||||
| Ordenamento magnético | diamagnetic | |||||||||||||||||||||||||||
| Resistividade elétrica | (20 ° C) 0,18 μΩ · m | |||||||||||||||||||||||||||
| Condutividade térmica | 46,1 W · m -1 · K -1 | |||||||||||||||||||||||||||
| Expansão térmica | (25 ° C) de 29,9 pM · · K -1 m -1 | |||||||||||||||||||||||||||
| Velocidade do som (haste fina) | (20 ° C), 818 m · s -1 | |||||||||||||||||||||||||||
| O módulo de Young | 8 GPa | |||||||||||||||||||||||||||
| Módulo de cisalhamento | 2,8 GPa | |||||||||||||||||||||||||||
| Massa de módulo | 43 GPa | |||||||||||||||||||||||||||
| Rácio de Poisson | 0.45 | |||||||||||||||||||||||||||
| Dureza de Mohs | 1.2 | |||||||||||||||||||||||||||
| Dureza Brinell | 26,4 MPa | |||||||||||||||||||||||||||
| Número de registo CAS | 7440-28-0 | |||||||||||||||||||||||||||
| A maioria dos isótopos estáveis | ||||||||||||||||||||||||||||
| Ver artigo principal: Isótopos de tálio | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
O tálio é um elemento químico de símbolo Tl e número atômico 81. Esta cinza suave de metal de pós-transição não é encontrado livre na natureza. Quando isolado, assemelha-se estanho , mas descolore quando exposto ao ar. Chemists William Crookes e Claude-Auguste Lamy descoberto tálio independente em 1861, em resíduos de ácido sulfúrico produção. Ambos usaram o método recém-desenvolvido de espectroscopia de chama, em que tálio produz uma linha espectral verde notável. Tálio, a partir de grego θαλλός, Thallos, que significa "um broto verde ou galho," foi nomeado por Crookes. Ele foi isolado por eletrólise, um ano depois, por Lamy.
Tálio tende a oxidar para os três estados de oxidação e um como sais iónicos. O estado 3 assemelha-se que um dos outros elementos do grupo de tálio (boro, alumínio, gálio, índio). No entanto, o estado 1, que é muito mais proeminente em tálio do que os elementos acima referidos que, recorda a química de metais alcalinos , e (I) são encontrados iões tálio geológico principalmente em minérios à base de potássio, e (quando ingerido) são tratadas em muitos aspectos como íons de potássio (K +) por bombas de íons em células vivas.
Comercialmente, contudo, não tálio é produzido a partir de minérios de potássio, mas como um subproduto da refinação de minérios de sulfureto de metal pesado. Cerca de 60-70% da produção de tálio é usado na indústria electrónica, e o restante é usado na indústria farmacêutica e na fabricação de vidro . Também é utilizado em Os detectores de infravermelhos. O radioisótopo de tálio-201 (como o cloreto de TlCl solúvel) é usado em quantidades pequenas, não tóxicas, como um agente numa verificação de medicina nuclear, durante um tipo de nuclear teste de estresse cardíaco.
Sais de tálio solúveis (muitos dos quais estão quase sem gosto) são altamente tóxico em quantidade, e foram historicamente utilizados em venenos de rato e insecticidas. A utilização destes compostos tem sido restringida ou proibida em muitos países, devido à sua toxicidade não selectivo. Envenenamento por tálio nomeadamente resulta em perda de cabelo. Devido à sua popularidade como um histórico arma do crime, tálio ganhou notoriedade como "veneno do envenenador" e "herança pó" (ao lado de arsênico ).
Características
Tálio é extremamente macio, maleável e sectile o suficiente para ser cortada com uma faca à temperatura ambiente. Ele tem um brilho metálico que, quando exposto ao ar, rapidamente mancha para uma coloração cinza-azulada, semelhante a liderança. Pode ser preservado por imersão em óleo. Uma espessa camada de óxido de tálio acumula-se sobre se deixou em ar. Na presença de água, tálio hidróxido é formado. Sulfúrico e ácido nítrico tálio dissolver-se rapidamente para realizar a e sulfato sais de nitrato, enquanto o ácido clorídrico forma uma insolúvel tálio (I) camada de cloreto. Sua potencial de eléctrodo padrão é -0,34, ligeiramente maior do que o potencial de ferro (pelo -0,44).
Isótopos
Tálio tem 25 isótopos que têm massas atômicas que variam de 184 a 210. 203 e 205 Tl Tl são os únicos isótopos estáveis, e 204 Tl é o mais estável radioisótopo, com uma meia-vida de 3,78 anos.
202 Tl (semi-vida de 12,23 dias) pode ser feita em um ciclotrão, enquanto 204 Tl é feita pela activação de neutrões de tálio estável em um reactor nuclear.
201 Tl (meia-vida de 73 horas), decai por captura eletrônica, emitindo raios-X de Hg (~ 70-80 keV), e fótons de 135 e 167 keV em 10% de abundância total; portanto, tem boas características de imagem sem dose de radiação excessiva paciente. Ele é o isótopo mais popular usado para o nuclear tálio testes de esforço cardíaco.
208 Tl (semi-vida de 3,05 minutos) é gerado no que ocorrem naturalmente cadeia de decaimento do tório. Sua proeminente 2.615 keV raios gama é a característica de alta energia dominante observada na naturais radiação de fundo.
Química
Os dois principais estados de oxidação de tálio são um e três. No estado de oxidação 1 a maioria dos compostos assemelham-se aos correspondentes potássio ou prata compostos (a raio iónico de tálio (I) é de 1,47 Um tempo que é de potássio 1,33 Â e de prata que é 1,26 Å), que foi a razão pela qual, por vezes, tálio foi considerado um metal alcalino na Europa (mas não em Inglaterra ) nos anos imediatamente após a sua descoberta. Por exemplo, a solúvel em água e muito básicos tálio (I) reage com o hidróxido de dióxido de carbono solúvel em água formando carbonato de tálio. Este carbonato é o único solúvel em água carbonato de metal pesado. A semelhança com compostos de prata é observado com os compostos de halogeneto, óxido ou sulfureto. De tálio (I), brometo é um composto amarelo fotossensível muito semelhante ao brometo de prata, enquanto o negro tálio (I) e óxido de tálio (I) sulfureto são muito semelhantes ao e óxido de prata sulfeto de prata.
Os compostos com estado de oxidação +3 assemelhar-se a compostos de alumínio (III) correspondente. Eles são agentes oxidantes moderadamente fortes, como ilustrado por o potencial de redução de 0,72 volts para Tl 3+ + 3-E - → Tl (s). O óxido de tálio (III) é um sólido branco que se decompõe acima de 800 ° C, formando o tálio (I), óxido e oxigénio.
História
Tálio ( grego θαλλός, Thallos, que significa "um broto verde ou galho") foi descoberto por espectroscopia de chama em 1861. O nome vem de tálio do brilhante espectral verde linhas de emissão.
Após a publicação do método melhorado de espectroscopia por chama Robert Bunsen e Gustav Kirchhoff ea descoberta de césio e rubídio nos anos 1859-1860, espectroscopia chama tornou-se um método aprovado para determinar a composição de minerais e produtos químicos. William Crookes e Claude-Auguste Lamy ambos começaram a usar o novo método. William Crookes usou para fazer determinações espectroscópicas para telúrio em compostos de selénio depositados na câmara de chumbo de uma usina de produção de ácido sulfúrico perto No Tilkerode Montanhas Harz. Ele tinha obtido as amostras por suas pesquisas sobre o cianeto de selênio Agosto Hofmann anos anteriores. Por 1862, Crookes conseguiu isolar pequenas quantidades de o novo elemento e determinar as propriedades de alguns compostos. Claude-Augusto Lamy utilizado um espectrómetro que era semelhante ao Crookes para determinar a composição de uma substância contendo selénio, que foi depositado durante a produção de ácido sulfúrico a partir de pirite . Ele também notou a nova linha verde no espectro e concluiu que um novo elemento estava presente. Lamy havia recebido este material a partir da planta de ácido sulfúrico de seu amigo Fred Kuhlmann e este subproduto estava disponível em grandes quantidades. Lamy começou a isolar o novo elemento a partir dessa fonte. O fato de Lamy foi capaz de trabalhar amplas quantidades de tálio lhe permitiu determinar as propriedades de vários compostos e, além disso, ele preparou um pequeno lingote de tálio metálico que ele preparado por refusão tálio tinha obtido por eletrólise de sais de tálio.
Como ambos os cientistas descobriram tálio de forma independente e uma grande parte do trabalho, especialmente o isolamento do tálio metálico foi feita por Lamy, Crookes tentou garantir a sua prioridade sobre o trabalho. Lamy foi premiado com uma medalha na Exposição Internacional em Londres 1862: Para a descoberta de uma nova e abundante fonte de tálio e após protesto pesado Crookes também recebeu uma medalha:. Tálio, para a descoberta do novo elemento A controvérsia entre ambos os cientistas continuaram através de 1862 e 1863. A maior parte da discussão terminou depois de Crookes foi eleito Fellow da Royal Society em junho de 1863.
O uso dominante de tálio foi o uso como veneno para roedores. Depois de vários acidentes o uso como veneno foi proibido nos Estados Unidos pela Presidential Executive Order 11643 em fevereiro de 1972. Nos anos seguintes vários outros países também proibiram o uso.
Ocorrência e produção
Apesar de tálio é um elemento modestamente abundante na crosta terrestre, com uma concentração estimada em cerca de 0,7 mg / kg, em associação com a maior parte do potássio baseados em minerais de argilas , solos , e granitos , tálio, geralmente não é economicamente recuperáveis a partir dessas fontes. A principal fonte de tálio para fins práticos, é a quantidade de rastreamento que é encontrado em cobre , chumbo , zinco , e outros pesados-metal- sulfureto minérios.

De tálio e é encontrado nos minerais Se crookesite TlCu 7 4, hutchinsonite TlPbAs 5 S 9, e lorandite Tlass 2. Tálio também ocorre como um oligoelemento em pirite de ferro , e tálio é extraído como um subproduto de ustulação deste mineral para a produção de ácido sulfúrico .
Tálio também pode ser obtido a partir da fundição de chumbo e zinco minérios. Nódulos de manganês encontrado no fundo do oceano também contêm alguns tálio, mas a recolha desses nódulos tem sido e continua a ser proibitivamente caro. Há também o potencial para danificar o meio ambiente dos oceanos. Além disso, vários outros minerais que contêm tálio, 16% a 60% de tálio, ocorrem na natureza na forma de complexos de sulfuretos ou selenetos que contêm principalmente antimónio , arsénio , cobre, chumbo e / ou prata . No entanto, estes minerais são raros, e eles tiveram nenhuma importância comercial, como fontes de tálio. O Allchar depósito no sul da Macedônia foi a única área onde tálio foi sempre ativamente minadas. Este depósito ainda contém um vagamente estimadas 500 toneladas de tálio, e é uma fonte para vários minerais raros tálio, por exemplo lorandite.
O United States Geological Survey (USGS) estima que a produção mundial anual de tálio é de cerca de 10 toneladas métricas como um subproduto da fundição de cobre, zinco e minérios de chumbo. Tálio ou é extraído das poeiras dos condutos fundição ou a partir de resíduos, tais como escória que são recolhidos no final do processo de fundição. As matérias-primas utilizadas para a produção de tálio contêm grandes quantidades de outros materiais e, por conseguinte, uma purificação é o primeiro passo. O tálio é lixiviado ou pela utilização de uma base ou de ácido sulfúrico a partir do material. O tálio é várias vezes precipitado a partir da solução e para remover mais impurezas. No final ele é convertido em sulfato de tálio e o tálio é extraído por electrólise em platina ou placas de aço inoxidável. A produção de tálio diminuiu cerca de 33% no período de 1995 a 2009 - de cerca de 15 métrica toneladas para cerca de 10 toneladas. Uma vez que existem vários pequenos depósitos ou minérios com teor relativamente elevado de tálio, seria possível aumentar a produção do mesmo, se uma nova aplicação, tal como uma hipotética contendo tálio supercondutor de alta temperatura, torna-se prático para o uso difundido fora do laboratório.
Aplicações
Usos históricos
O e inodoro insípido sulfato de tálio foi uma vez amplamente utilizado como veneno de rato e formiga assassino. Desde 1972, esse uso foi proibido no Estados Unidos devido a preocupações de segurança. Muitos outros países seguiram esse exemplo nos anos seguintes. Sais de tálio foram usadas no tratamento de micose, outro infecções da pele e para reduzir o sudorese noturna de tuberculose pacientes. No entanto, esta utilização tem sido limitada devido à sua estreita índice terapêutico, e o desenvolvimento de medicamentos mais avançados para estas condições.
Ótica
De tálio (I), brometo e de tálio (I) de iodeto de cristais têm sido usados como materiais ópticos de infravermelhos, porque eles são mais duros do que outras ópticas infravermelhos comuns, e porque têm a comprimentos de onda de transmissão significativamente mais longos. O nome comercial KRS-5 refere-se a este material. De tálio (I), óxido foi usado para fabricar óculos que têm uma alta índice de refração. Combinado com enxofre ou selénio e arsénio , tálio foi usado na produção de alto densidade vidros que têm baixos pontos de fusão na gama de 125 e 150 ° C . Estes óculos têm propriedades de temperatura ambiente que são semelhantes aos óculos comuns e são duráveis, insolúvel em água e têm exclusivo índices de refração.
Eletrônica

De tálio (I) de sulfureto alterações de condutividade elétrica com exposição a Por conseguinte, a luz infravermelha tornando este composto útil em fotorresistências. Seleneto de tálio foi usado numa bolómetro para detecção de infravermelhos. Doping semicondutores selênio com tálio melhora seu desempenho e, portanto, ele é usado em quantidades vestigiais na retificadores de selênio. Outra aplicação de tálio é o doping cristais de iodeto de sódio em dispositivos de detecção de radiação gama. Nestes, os cristais de iodeto de sódio são dopados com uma pequena quantidade de tálio para melhorar a sua eficiência como geradores de cintilação. Alguns dos eléctrodos analisadores de oxigênio dissolvido contêm tálio.
Supercondutividade de alta temperatura
A atividade de pesquisa com tálio está em curso para desenvolver alta temperatura supercondutores materiais para aplicações como ressonância magnética, armazenamento de energia magnética, propulsão magnética, e geração de energia elétrica e de transmissão. A pesquisa em aplicações iniciado após a descoberta do primeiro tálio bário cálcio supercondutor de óxido de cobre em 1988.
Médico
Antes da aplicação generalizada de tecnécio-99m em medicina nuclear, o isótopo radioactivo tálio-201, com meia-vida de 73 horas, foi a principal substância para cardiografia nuclear. O nuclide ainda é usado para testes de estresse para estratificação de risco em pacientes com doença arterial coronariana (DAC). Este isótopo de tálio pode ser gerado usando um gerador transportável que é semelhante à que se gerador de tecnécio-99m. O gerador contém levar-201 (semi-vida de 9,33 horas) que decai por captura de elétrons ao tálio-201. O chumbo-201 pode ser produzido numa ciclotrão pelo bombardeio de tálio com prótons ou dêuterons por (p, 3n) e (D), 4n reacções.
Teste de estresse tálio
Um teste de estresse tálio é uma forma de cintilografia, onde a quantidade de tálio em tecidos correlaciona-se com o fornecimento de sangue tecido. Células cardíacas viáveis têm normais Na bombas de troca iônica + / K +. O catião Tl + liga-se a bombas de K + e é transportado para dentro das células. Exercício ou induz dipiridamol alargamento ( vasodilatação) de artérias coronárias normais. Isso produz roubo coronariano de áreas onde as artérias estão maximamente dilatados. Áreas de infarto ou tecido isquêmico permanecerá "frio". Tálio pré e pós-stress pode indicar áreas que beneficiarão de miocárdio revascularização. Redistribuição indica a existência de roubo coronariano ea presença de isquêmica doença arterial coronariana.
Outros usos
Uma liga de mercúrio, tálio, que forma um eutéctica em 8,5% de tálio, é relatado para congelar a -60 ° C, cerca de 20 ° C abaixo do ponto de congelação de mercúrio. Esta liga é usado em termômetros e interruptores de baixa temperatura. Na síntese orgânica, de tálio (III) sais, como o trinitrato de tálio ou triacetato, são reagentes úteis realizando transformações diferentes de substâncias aromáticas, cetonas, olefinas, entre outros. De tálio é um componente da liga na placas de ânodo em baterias de água do mar de magnésio. Sais de tálio solúveis são adicionados à banhos de revestimento de ouro para aumentar a velocidade de revestimento e para reduzir o tamanho do grão dentro da camada de ouro.
A solução saturada de partes iguais de tálio (I) formato de (Tl (CHO 2)) e tálio (I) malonato de (Tl (C 3 H 3 O 4)) em água como é conhecido Solução de Clerici. É um líquido inodoro móvel cujas mudanças de cor amarelada para limpar sobre a redução da concentração dos sais de tálio. Com a densidade de 4,25 g / cm3 a 20 ° C solução, Clerici é um dos mais pesados soluções aquosas conhecidas. Utilizou-se, no século 20 para medir a densidade de minerais pela método de flutuação, mas o uso é interrompido devido à elevada toxicidade e corrosividade da solução.
Iodeto de tálio e é usado como um aditivo para lâmpadas de halogeneto de metal, muitas vezes juntamente com um-dois halogenetos de outros metais. Ele permite optimizar a temperatura de cor da lâmpada e de processamento, e deslocar a saída para a região espectral verde, que é útil para iluminação debaixo de água.
Toxicidade
Tálio e seus compostos são extremamente tóxicos, e deve ser manuseado com muito cuidado. Existem inúmeros casos registrados de intoxicação por tálio fatal. Contato com a pele é perigoso, e uma ventilação adequada deve ser fornecida quando derreter este metal. Tálio (I) os compostos têm uma solubilidade aquosa elevada e são facilmente absorvidos através da pele. Exposição a eles não deve exceder 0,1 mg por m 2 de pele em uma média ponderada no tempo de 8 horas (40 horas de trabalho por semana). De tálio é um humano suspeito cancerígena. Por um longo tempo compostos de tálio foram facilmente disponíveis como veneno de rato. Este fato e que é solúvel em água e quase sem gosto levou a intoxicações frequentes causados por acidente ou intenção criminosa.
Tratamento e descontaminação interna
Um dos principais métodos de remoção de tálio (ambos radioactivos e normal) a partir de seres humanos é a utilização Azul da Prússia, um material que absorve tálio. Até 20 g por dia de azul da Prússia é alimentado por via oral para a pessoa, e que passa através do seu sistema digestivo e sai na fezes. Hemodiálise e hemoperfusão também são usadas para remover do tálio a partir do soro do sangue. Na fase posterior do tratamento de potássio adicional é utilizado para mobilizar tálio a partir do tecido.
Poluição tálio
De acordo com United States Environmental Protection Agency (EPA), as fontes artificiais de poluição tálio incluem emissão de gases de fábricas de cimento, usinas de carvão queimando e esgotos de metal. A principal fonte de concentrações elevadas de tálio em água é a lixiviação de tálio a partir de operações de processamento de minério.
